Влияние различных источников аминокислот на состав кишечной микрофлоры мясных кур и петухов родительского стада кросса «Смена 9»

Реализация генетического потенциала птиц без дополнительного включения в комбикорма основных незаменимых синтетических аминокислот невозможна. Однако в последние годы произошло резкое увеличение стоимости данных важнейших сырьевых компонентов, необходимых для производства комбикормов, что инициирует проведение исследований в направлении поиска наиболее экономически эффективных источников аминокислот.
Как известно, метионин является первой лимитирующей незаменимой аминокислотой для сельскохозяйственной птицы. Различные источники метионина могут быть использованы организмом птицы с помощью уникального ферментативного пути, включающего оксидазу D-аминокислот, которая может превращать D-изомер или аналог в L-изомер в печени и почках. Традиционно метионин вводят в рацион птиц в основном в виде DL-метионина. Однако синтетическим источником метионина в комбикорме может явиться не только сухой DL-метионин, но и его жидкий гидроксианалог, применение которого экономически более выгодно. Ряд исследователей считают, что гидроксианалог метионина не менее эффективен, чем DL-метионин. Другие авторы имеют противоположную точку зрения, поэтому значение форм метионина в птицеводстве требует более углубленного исследования.
Лизин также является незаменимой аминокислотой для птиц, но чрезмерная концентрация кормового лизина может оказывать негативное воздействие на птиц, например снижать набор живой массы и увеличивать частоту серьезных проблем с лапами.
Обычной формой, в которой лизин добавляется в рацион бройлеров, является лизин гидрохлорид, который содержит 78% доступного лизина. Сульфат L-лизина является альтернативой L-лизину гидрохлориду. Он содержит 52% доступного лизина, его использование является весьма привлекательным как по экологическим, так и по экономическим причинам. Ввод монохлоргидрата лизина приводит к завышению в корме уровня хлора в комбикормах при их балансировании по лизину.
Как известно, избыток хлора в рационе вызывает такие негативные эффекты, как снижение иммунитета и нарушение обмена веществ. В отличие от кристаллического лизина гидрохлорида, лизин сульфат не содержит хлора, но содержит побочные продукты ферментации углеводов и высушенные микробные клетки. По мнению некоторых исследователей, присутствие высушенных микробных клеток придает L-лизин сульфату дополнительную питательную ценность, что может положительно отражаться на продуктивности и метаболических характеристиках цыплят-бройлеров. Однако, как показали H. Jia и соавт., чрезмерное добавление лизина сульфата в рацион из кукурузно-соевой муки оказывает негативное воздействие на бройлеров.
С другой стороны, эффективность использования племенной птицы родительских стад, в частности количество цыплят, полученных от каждой родительской пары, в высокой степени определяется воспроизводительными качествами несушек и петухов. Но необходимо отметить, что некоторые значимые признаки продуктивности сельскохозяйственных птиц имеют отрицательную биологическую корреляционную зависимость. Так, живая масса и масса яиц находятся в отрицательной связи с воспроизводительными качествами, к которым относят яйценоскость, оплодотворяемость и выводимость яиц, а также выход молодняка. Поэтому для снижения отложения в организме птиц родительского поголовья жира и сдерживания нарастания живой массы применяется количественное ограничение в корме, в том числе уменьшение уровня аминокислот и энергии за счет включения в рецепты комбикормов компонентов с повышенным уровнем клетчатки. Тем не менее этот прием не должен оказывать отрицательное влияние на состояние здоровья. Существуют противоречивые сведения о воздействии рационов со сниженным количеством обменной энергии на здоровье животных и птиц. Кроме того, на птице родительского поголовья нового кросса «Смена 9» такие исследования не проводились.
Важно отметить, что желудочно-кишечный тракт цыплят, где происходят переваривание и всасывание компонентов рациона (в том числе аминокислот), содержит очень сложные и разнообразные микробные сообщества, включающие как полезные, так и нежелательные бактерии. Но динамический баланс, как правило, поддерживается таким образом, что полезные бактерии преобладают над вредными.
Кишечная микробиота играет решающую роль в переваривании корма и усвоении питательных веществ у сельскохозяйственной птицы. Она имеет связь с коэффициентом конверсии корма, приростом массы тела, здоровьем, мясной и яичной продуктивностью птиц. Количество и тип микробных сообществ в каждом отделе кишечника варьируют в зависимости от поступления питательных веществ из рациона, иммунных реакций хозяина и метаболитов, вырабатываемых этой сложной микробной системой в кишечнике.
Такие факторы, как стрессы и условия содержания, а также состав рациона, могут вызывать пагубные изменения в изменении баланса кишечной микрофлоры, приводящие к ухудшению здоровья птиц, снижению производственных показателей, включая качество и выход инкубационных яиц, а также репродуктивное здоровье кур и петухов.
Ранее в опытах изучено влияние гидроксианалога метионина на состав микрофлоры кишечника бройлеров кросса «Росс 308». Тем не менее отсутствуют данные о специфическом воздействии различных источников метионина, лизина и рационов со сниженным (по сравнению с нормой) количеством обменной энергии на состав микрофлоры кишечника птиц нового отечественного кросса «Смена 9».
Цель исследования — сравнение влияния добавления в рацион кормления лизина и метионина в различных формах на фоне базового и сниженного количества обменной энергии на состав кишечной микрофлоры кур и петухов кросса «Смена 9», а также установление связи состава микрофлоры на разных рационах с зоотехническими показателями птиц, включая качество инкубационных яиц.
Материалы и методы
На базе вивария СГЦ «Загорское ЭПХ» (Московская обл., Россия) в 2023 году проведены физиологические исследования намясных курах породы плимутрок и петухах породы корниш родительского стада отечественного кросса «Смена 9» селекции СГЦ «Смена» (Московская обл., Россия).
В начале продуктивного периода в возрасте 25 недель были сформированы 4 группы (контрольная 1А и опытные 2А-4А) по 9 голов кур и 4 группы по 9 голов петухов (контрольная 1Б и опытные 2Б-4Б). Каждая птица размещалась в отдельной клетке.

Питательность комбикормов для мясных кур контрольной группы соответствовала «Руководству по работе с птицей мясного кросса “Смена 9”», 2021 г.
Птиц кормили рассыпными комбикормами. Структура и рецепт комбикормов для кур представлены в таблице 2. Каждая несушка на пике продуктивности получала ежедневно в утренние часы по 165 г комбикорма в расчете на голову.
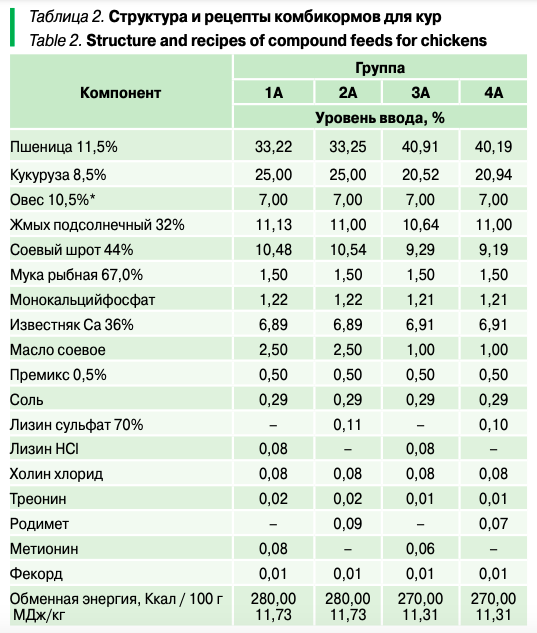
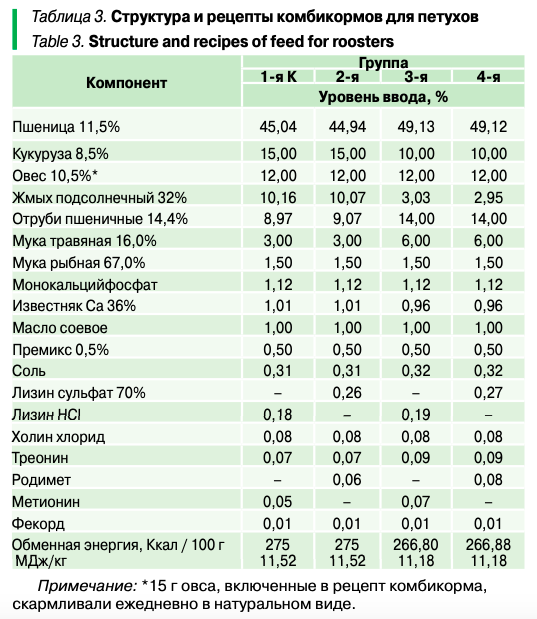
Каждый петух ежедневно в утренние часы получал по 130 г комбикорма и через два часа — по 15 г зерна овса.
Уровни добавки в комбикорма всех биологически активных веществ обеспечивали за счет использования премикса.
Для поения использовали ниппельные поилки, а для освещения применяли лампы накаливания, длина светового дня составляла 14 часов при интенсивности освещения 20–25 лк.
Оплодотворяющую способность спермы от петухов всех групп определяли путем искусственного осеменения кур породы плимутрок. Для взятия спермы 2 раза в неделю петухов массажировали и полученной спермой в 35-недельном возрасте осеменяли 4 группы кур-несушек породы плимутрок (по 10 голов в каждой).
От каждой группы собирали по 100 яиц и закладывали на инкубацию.
Убой кур и петухов проводили в 35-недельном возрасте.
При постановке эксперимента были соблюдены требования Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях (ETS № 123, г. Страсбург, 1986).
Отбор проб содержимого слепых отростков кишечника птиц (в трех повторностях) проводили в конце эксперимента (35 недель) с максимально возможным соблюдением условий асептики. Все образцы замораживали при -20 ℃ и транспортировали в сухом льду в лабораторию ООО «БИОТРОФ+».
Тотальную ДНК из образцов выделяли с использованием набора Genomic DNA Purification Kit (Thermo Fisher Scientific, Inc., США) согласно инструкции. Реакции амплификации проводили на амплификаторе DTLight (ДНК-Технология, Россия). Праймеры для детекции микроорганизмов в пробах были разработаны с использованием программы NCBI/Primer-BLAST Анализ бактерий в пробах проводили методом ПЦР в реальном времени с помощью «Набора реактивов для проведения ПЦР-РВ в присутствии интеркалирующего красителя EVA Green» (ЗАО «Синтол», Россия) и праймеров (5’–3′).
Математическую и статистическую обработку результатов осуществляли методом многофакторного дисперсионного анализа (Multifactor ANalysis Of VAriance, ANOVA) в программах Microsoft Excel XP/2003 (США), R-Studio (Version 1.1.453). Достоверность различий устанавливали по t-критерию Стьюдента, различия считали статистически значимыми при р ≤ 0,05. Средние значения сравнивали с использованием теста достоверно значимой разницы Тьюки (HSD) и функции TukeyHSD в пакете R Stats Package.
Результаты и обсуждение
Для выявления возможных различий в составе микрофлоры кишечника с зоотехническими показателями птиц были изучены параметры живой массы, воспроизводительной способности и качества инкубационных яиц кур кросса «Смена 9» (табл. 4).
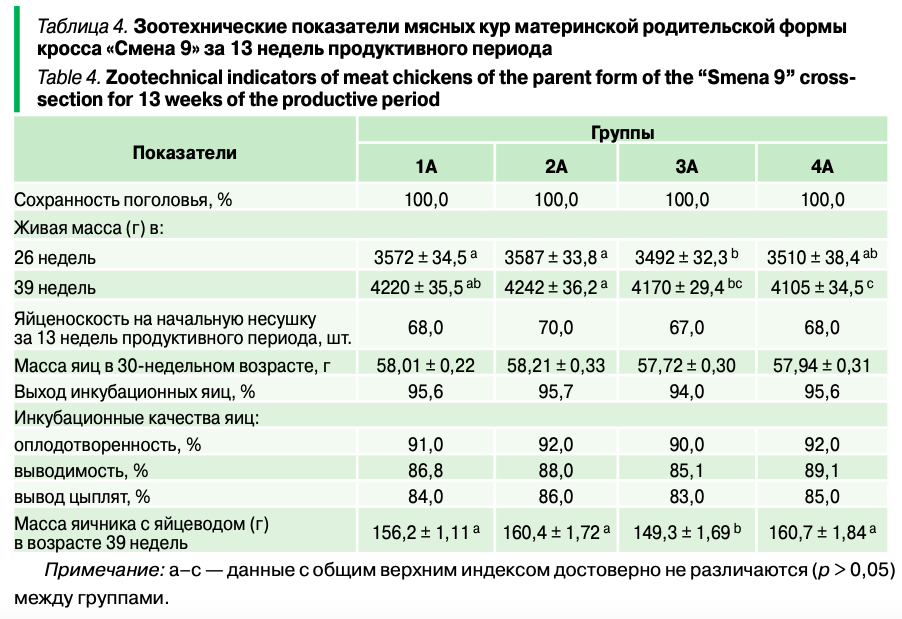
Из таблицы 4 видно, что достоверных изменений между группами по таким показателям, как яйценоскость, масса яиц, выход инкубационных яиц, инкубационные качества яиц, не отмечено (р > 0,05). При этом снижение уровня обменной энергии в рационах (опытные группы 3А и 4А) от уровня базового рациона (контрольная группа 1А и опытная 2А) приводило к ожидаемому эффекту — уменьшению живой массы кур в группе 3А в 26 недель, в группе 4А — в 39 недель (р ≤ 0,05). Однако в группе 3А при введении в рацион лизина в форме монохлоргидрата и DL-метионина отмечено и снижение массы яичников с яйцеводом на 6,9 г на фоне уменьшения уровня обменной энергии по сравнению с группой 1А с базовым уровнем обменной энергии (р ≤ 0,05). При этом в группе 4А при использовании лизина в форме сульфата и метионина в форме гидроксианалога метионина подобного эффекта снижения не отмечено (р > 0,05), что свидетельствует о большей эффективности этих источников аминокислот.
Важно подчеркнуть изучаемые факторы кормления: различные источники лизина и метионина и уровня обменной энергии по-разному повлияли на организм кур и петухов.
Как видно из таблицы 5, показатели живой массы, а также абсолютной и относительной массы семенников во всех вариантах были неизменны (р > 0,05).
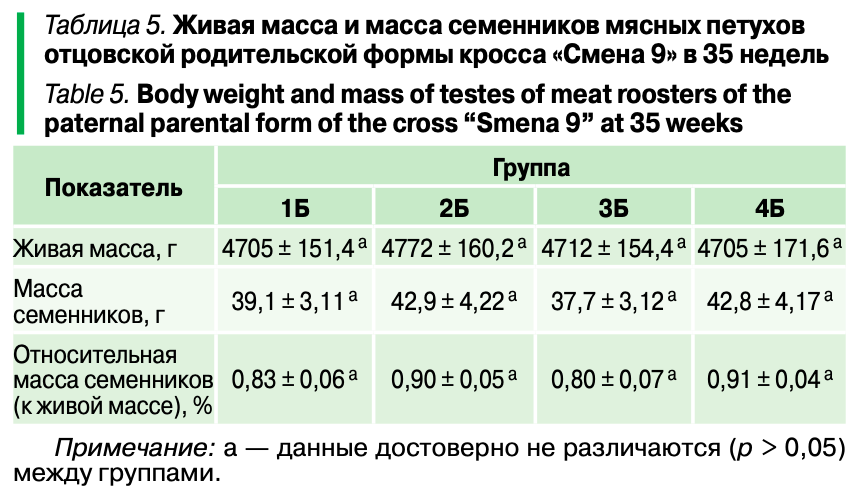
Методом количественной ПЦР в пробах слепых отростков кишечника кур и петухов (табл. 6) подопытного и контрольного поголовья было установлено изменение некоторых представителей нормофлоры, условно-патогенной и патогенной микрофлоры под влиянием изучаемых параметров.
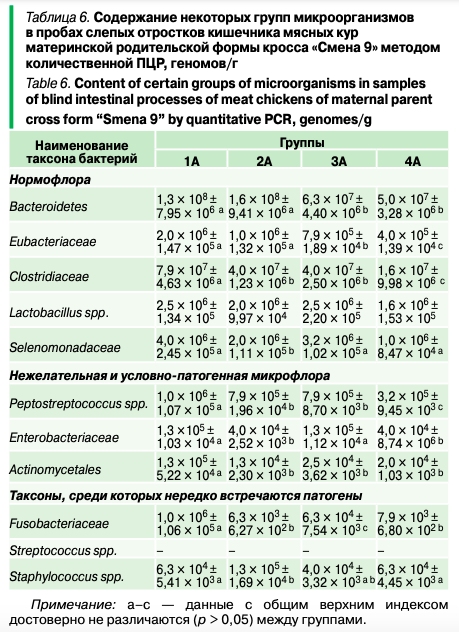
Исследования показали, что не было отмечено связи между применением разных источников аминокислот в комбикормах, а также снижением обменной энергии на 5% с составом микрофлоры слепых отростков кишечника несушек, однако в группах 2А–4А изменялось количественное соотношение некоторых таксонов бактерий по сравнению с контрольной группой 1А (р ≤ 0,05).
Так, при снижении уровня обменной энергии в рационе наблюдалось уменьшение (от 1,2 до 5,0 раз) таких представителей нормофлоры, как Bacteroidetes и Eubacteriaceae в группах 3А и 4А по сравнению с контролем 1А и группой 2А (р ≤ 0,05). Это могло быть связано со снижением живой массы кур, поскольку, как было показано в опытах не млекопитающих, численность бактерий Bacteroidetes находится в прямой зависимости от набора массы тела и ожирения. Bacteroidetes и Eubacteriaceae — это бактерии-комменсалы, которые вырабатывают летучие жирные кислоты (ЛЖК), такие как ацетат, пропионат, бутират и лактат. Эти ЛЖК играют специфическую роль в пищеварительной системе, такую как вклад в увеличение уровня энергии за счет усиления глюконеогенеза и уменьшение нежелательных видов бактерий в кишечнике.
ЛЖК стимулируют пролиферацию и дифференцировку клеток эпителия кишечника и увеличивают высоту ворсинок, тем самым увеличивая площадь поглощающей поверхности кишечника. Ацетат и пропионат также действуют как энергетический субстрат для тканей. Большинство филотипов бактерий, распространенных у птиц с более высоким потреблением корма и более высокими показателями прироста живой массы, являются, как правило, микроорганизмами с известными полезными метаболическими характеристиками.
Ранее многочисленные исследования показали, что состав рациона вносит основной вклад в изменение разнообразия кишечного микробиома — как в краткосрочной, так и в долгосрочной перспективе. Например, было доказано, что рацион с высоким содержанием животного белка был связан с увеличением количества Bacteroides spp., Alistipes spp. и Bilophila spp., в то время как количество Lactobacillus spp. и Roseburia spp. уменьшалось.
Кроме того, в опытных группах 2А–4А происходило снижение практически во всех случаях нежелательных бактерий, таких как пептострептококки, энтеробактерии и актиномицеты, а также патогенных фузобактерий по сравнению с контролем 1А (р ≤ 0,05), которые при ослаблении резистентности могут вызывать воспалительные заболевания у птиц. Так, например, снижение фузобактерий в группах 2А–4А достигало от 126,6 до 158,7 раза по сравнению с контрольной группой 1А (р ≤ 0,05). Ранее S. Kumar и соавт. обнаружили увеличение содержания пептострептококков в слепых отростков кишечника при снижении уровня метионина в рационе бройлеров Cobb 500 в возрасте 21 и 42 дней. Хотя пептострептококк является частью нормальной микробиоты кишечника, он считается условно-патогенным микроорганизмом. L. Yan и соавт. обнаружили, что крупноизмельченная кукуруза увеличивала количество пептострептококка в подвздошной кишке, то есть пептострептококк потенциально процветает в условиях, богатых питательными веществами.
Проведенные исследования еще раз доказывают, что в результате изменения рациона может быть снижен или, напротив, увеличен риск определенных заболеваний, в частности возникающих из-за воспаления эпителия кишечника.
По мнению авторов, изменения в составе микрофлоры в группе 2А по сравнению с группой 1А могут быть связаны с тем, что гидроксианалог метионина по сравнению с DL-метионином связан со снижением буферной емкости корма.
Необходимо отметить, что изменение в составе микрофлоры в группе 3А могло иметь связь со снижением массы яичников с яйцеводом. Ранее было высказано предположение, что кишечная микробиота и ее метаболиты, такие как короткоцепочечные жирные кислоты, желчные кислоты и производные триптофана, косвенно влияют на воспроизводительную способность птиц по оси «микробиота — кишечник — печень / мозг — репродуктивный тракт». Обилие некоторых кишечных микробов положительно коррелировало с уровнями фолликулостимулирующего гормона в сыворотке крови, лютеинизирующего гормона и эстрадиола, что дополнительно указывает на связи, участвующие в регуляции продуктивных показателей у кур-несушек.
Улучшение структуры эпителия кишечника, вызванное метаболитами бактерий — летучими жирными кислотами вейлионелл, способствовало всасыванию кальция, увеличивая отложение кальция в яичной скорлупе и толщину яичной скорлупы. Исследования на петухах показали, что содержание Eubacteriaceae, Peptostreptococcus spp. и Enterobacteriaceae в слепых отростках кишечника, в отличие от кур, в группах 1Б–4Б оставалось одинаковым и не менялось в зависимости от источников аминокислот и количества обменной энергии в рационе (р > 0,05) (табл. 7).
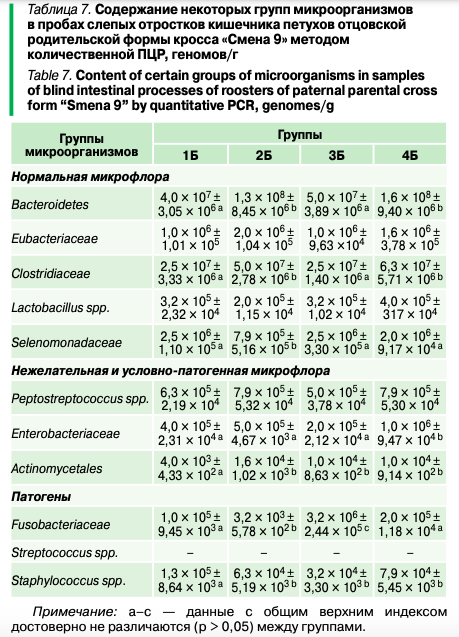
Интересно, что в группе 3Б (на фоне снижения обменной энергии) не было отмечено каких-либо изменений в составе всех исследованных представителей нормофлоры по сравнению с контрольной группой 1Б (р > 0,05). Такие изменения могут быть связаны с различным гормональным фоном у самок и самцов. Ранее в исследовании, проведенном на зимующих птицах, показано, что разнообразие и равномерность микробиоты были выше у самцов, чем у самок. J.G. Kers и соавт. указывали на различия в составе микрофлоры между курами и петухами у промышленного поголовья птиц. Тем не менее в слепых отростках кишечника петухов отзывчивыми на изменение рациона оказались такие бактерии, как Actinomycetales, Fusobacteriaceae и Staphylococcus spp. Общей тенденцией для всех групп оказалось то, что содержание Actinomycetales увеличивалось в группах 2Б–4Б по сравнению с контролем 1Б, а Staphylococcus spp., напротив, снижалось (р ≤ 0,05). Ранее было установлено, что некоторые кишечные микроорганизмы активно экспрессируют γ-аминомасляную кислоту (ГАМК). Интересно, что ГАМК связана с процессом конденсации сперматозоидов, способствует фосфорилированию тирозина белка спермы, который является показателем емкости сперматозоидов, а также акросомной реакции, которая ингибируется селективными антагонистами ГАМК-рецепторов.
Исследование на грызунах показало, что ГАМК уменьшает чрезмерную активацию сперматозоидов путем ингибирования связывания 5-НТ с 5-НТ2 рецепторами, тем самым совместно регулируя активацию сперматозоидов с помощью 5-НТ. Тем не менее в исследовании отсутствовала связь состава изученных микроорганизмов с показателями массы семенников у петухов, а также показателями оплодотворяемости.
Выводы
Как показал метод количественной ПЦР, изучаемые факторы кормления — различные источники лизина и метионина и сниженный на 5% уровень обменной энергии корма — по-разному повлияли на состав микрофлоры кур и петухов родительского поголовья нового кросса «Смена 9».
Судя по зоотехническим показателям и составу кишечной микрофлоры, куры оказались более чувствительны к изменению состава рациона, чем петухи. На фоне уменьшения уровня обменной энергии при введении в рацион лизина в форме монохлоргидрата и DL-метионина у кур отмечено снижение массы яичников с яйцеводом, тогда как при использовании лизина в форме сульфата и метионина в форме гидроксианалога метионина подобного эффекта не отмечено, что, вероятно, свидетельствует о лучшем влиянии этих источников аминокислот на показатели репродуктивного здоровья. При этом сдвиги в составе микрофлоры на фоне изменения рационов были связаны с изменением живой массы кур, а также массы яичников, однако не имели какой-либо связи с изученными зоотехническими параметрами у петухов.
Кроме того, изменение рациона и, как следствие, состава микрофлоры кишечника не показало какой-либо связи с выходом инкубационных яиц и их качеством. Однако точные механизмы, с помощью которых различные источники лизина и метионина и сниженный уровень обменной энергии корма повлияли на состав микрофлоры кур и петухов в данном исследовании, остаются неясными, что требует проведения дополнительных исследований в этом направлении.
Об авторах
- Елена Александровна Йылдырым1, доктор биологических наук
- deniz@biotrof.ru; https://orcid.org/0000-0002-5846-5105
- Лариса Александровна Ильина1, доктор биологических наук
- ilina@biotrof.ru; https://orcid.org/0000-0003-2789-4844
- Георгий Юрьевич Лаптев1, доктор биологических наук
- laptev@biotrof.ru; https://orcid.org/0000-0002-8795-6659
- Валентина Анатольевна Филиппова1, биотехнолог
- filippova@biotrof.ru; https://orcid.org/0000-0001-8789-9837
- Андрей Валерьевич Дубровин1, кандидат ветеринарных наук
- dubrowin.a.v@yandex.ru; https://orcid.org/0000-0001-8424-4114
- Дарья Георгиевна Тюрина1, кандидат экономических наук
- tiurina@biotrof.ru; https://orcid.org/0000-0001-9001-2432
- Ксения Андреевна Калиткина1, биотехнолог
- ksenya.k.a@biotrof.ru; https://orcid.org/0000-0002-9541-6839
- Алиса Сергеевна Дубровина1, биотехнолог
- dasvet@biotrof.ru; https://orcid.org/0009-0005-1879-7497
- Екатерина Сергеевна Пономарева1, биотехнолог
- kate@biotrof.ru; https://orcid.org/0000-0002-4336-8273
- Владимир Иванович Фисинин2, академик РАН, доктор сельскохозяйственных наук, профессор, научный руководитель
- https://orcid.org/0000-0003-0081-6336
- Иван Афанасьевич Егоров2, академик РАН, доктор биологических наук, профессор
- https://orcid.org/0000-0001-9122-9553
- Татьяна Анатольевна Егорова2, доктор сельскохозяйственных наук, заместитель директора по научно-исследовательской работе
- eta164@yandex.ru; https://orcid.org/0000-0002-5102-2248
- Вардгес Агавардович Манукян2, доктор сельскохозяйственных наук, главный научный сотрудник, заведующий отделом питания птицы
- manukyan@vnitip.ru; https://orcid.org/0000-0003-4564-4427
- Татьяна Николаевна Ленкова2, доктор сельскохозяйственных наук, профессор, учёный секретарь
- dissоvet@vnitip.ru; https://orcid.org/0000-0001-8391-5000
- Ольга Николаевна Дегтярева2, кандидат сельскохозяйственных наук, научный сотрудник
- fncvnitip@mail.ru; https://orcid.org/0000-0001-7243-7381
- Мария Сергеевна Тишенкова2, младший научный сотрудник
- tishenkova.m@yandex.ru; https://orcid.org/0000-0002-2911-5640
- Екатерина Сергеевна Демидова2, младший научный сотрудник
- mixalysha@mail.ru; https://orcid.org/0000-0002-0108-2218
- Лев Михайлович Кашпоров2, специалист
- lev-lud2@live.ru; https://orcid.org/0009-0000-5100-4843
- Виктория Евгеньевна Пащенко2, аспирант, младший научный сотрудник
- viktoriia_pashchenko@mail.ru; https://orcid.org/0000-0001-7484-196X
1 ООО «БИОТРОФ+», бульвар Загребский, 19/1, Санкт-Петербург, 192288, Россия
2 Федеральный научный центр «Всероссийский научно-исследовательский и технологический институт птицеводства»; ул. Птицеградская, 10, Сергиев Посад, 141311, Россия
УДК 619:616.98:579.852.13 DOI: 10.32634/0869-8155-2024-379-2-53-60
Сельское хозяйство, ветеринария, зоотехния, агрономия, агроинженерия, пищевые технологии





















