Развитие антибиотикорезистентности микроорганизмов у цыплят-бройлеров под влиянием ветеринарных антибиотиков и пробиотика

Современная интенсивная технология выращивания птицы предполагает широкое применение антимикробных препаратов. В последние годы можно наблюдать общемировую тенденцию по ограничению применения антибактериальных средств в птицеводстве. В частности, в России установлен запрет на использование противомикробных препаратов для ветеринарного применения не в лечебных целях с 2020 г.
Потребители демонстрируют интерес к продукции птицеводства, полученной без использования антимикробных веществ вообще или без использования их медицински значимых аналогов.
Тем не менее специалисты продолжают применять разнообразные антимикробные препараты. Принято выделять так называемые ветеринарные и кормовые антибиотики. Кормовой антибиотик (или так называемый стимулятор роста) может быть определен как лекарственное средство, которое обладает бактериостатическим либо бактерицидным действием, а также применяется в низких субтерапевтических дозах.
Ветеринарные антибиотики в птицеводстве могут назначаться с целью лечения, контроля за распространением заболевания, профилактики, метафилактики заболеваний. На практике бывает сложно отделить намерения применения антимикробных препаратов, поскольку зоотехнические и ветеринарные подходы могут преследовать общие цели.
В продукции птицеводства, представленной на рынке России, обнаруживаются остаточные количества антимикробных веществ. Угрозу здоровью и благополучию человека представляют как сами остаточные количества антимикробных препаратов, так и распространяющаяся в результате их применения антибиотикорезистентность микроорганизмов. Каналами передачи генов устойчивости к антимикробным препаратам выступают сотрудники птицеводческих предприятий и сама продукция птицеводства.
Кроме того, внесение на поля органических удобрений, полученных из подстилки и помета птиц, способствует попаданию как самих антимикробных препаратов, так и устойчивых микроорганизмов в водоемы и почву. Особенно высокий уровень загрязнения показывают овощи и зелень. Однако, несмотря на важность проблемы антибиотиков и лекарственной устойчивости, наблюдается недостаточное изучение вопросов возникновения устойчивых к антимикробным препаратам микроорганизмов в птицеводстве. Кроме того, слабо освещены вопросы применения заменителей кормовых антибиотиков вместе с ветеринарными антибиотиками.
Цель исследования — изучение антибиотикорезистентности микроорганизмов, развившейся вследствие приема ветеринарных антибиотиков, с помощью молекулярно-генетических и классических методов микробиологии. Раскрытие возможностей изменения количества устойчивых микроорганизмов под влиянием скармливания цыплятам-бройлерам метапробиотика на основе спорообразующих микроорганизмов.
Материалы и методы
Эксперимент проводили на цыплятах-бройлерах кросса Ross 308, продолжительность выращивания — с суточного возраста до 35 дней в виварии ООО «БИОТРОФ» (г. Санкт-Петербург, Россия) в 2022 году.
Условия кормления, поения, содержания соответствовали требованиям кросса.
Были сформированы три группы цыплят (по 35 голов в каждой группе):
I — контрольная, получавшая полнорационный комбикорм для бройлеров ПК-5 до 28 дней, ПК-6 — до окончания выращивания;
II — опытная, получавшая дополнительно к рациону I группы ветеринарные антибиотики энрофлоксацин («Энроксил», 10%-ный раствор для перорального применения, KRKA, Словения) 1–5-е сутки выращивания и колистин («Колистин» 2 млн, АВЗ-СП, Россия) 27–31-е сутки выращивания в соответствии с инструкцией производителя;
III — опытная группа, получавшая дополнительно к рациону II группы метапробиотик «Пробиоцид-Ультра» на основе пробиотических штаммов микроорганизмов рода Bacillus и смеси органических кислот и солей органических кислот («БИОТРОФ», Россия). В состав рецепта комбикорма не были включены кормовые антибиотики.
Для определения экспрессии генов антибиотикорезистентности кишечной микрофлоры птицы на 1-е, 3-и, 5-е, 29-е, 31-е сутки прижизненно отбирались пробы фекалий от трех птиц из каждой группы в пластиковые микропробирки типа «эппендорф». Образцы стабилизировали с помощью реагента RNAlater (Thermo Fisher Scientific Inc., США) и незамедлительно отправляли в молекулярно-генетическую лабораторию ООО «БИОТРОФ» для выделения РНК. Далее формировалась среднесмешанная проба от каждой группы.
Пробы микрофлоры в первый день отбирались через 12 часов от начала выпойки антибиотика.
Таргетный анализ генов антибиотикорезистентности был выполнен методом количественной ПЦР с использованием амплификатора ДТлайт («ДНК-Технология», Россия) из расчета по отношению к копии гена 16S-рРНК. Реакцию амплификации с праймерами генов интереса проводили при помощи набора SsoAdvanced Universal SYBR Green Supremix (BioRad, США) согласно протоколу производителя.
Относительную экспрессию оценивали методом 2-ΔΔCT. В качестве референсного гена был выбран Eub для фрагмента гена 16S рРНК. Следует отметить, что данный анализ предполагает оценку изменения резистома всего микробиома; результаты представляются в относительных величинах по отношению к уровню контрольной группы.
Детерминанты антибиотикорезистентности (табл. 1) были выбраны, с тем чтобы попытаться оценить устойчивость микробиома как к употребленными птицами энрофлоксацину и колистину, так и к другим антимикробным препаратам.

Выбранные праймеры позволяют оценить распространение генов антибиотикорезистентности к фторхинолонам (gyrA, gyrB, parC, parE), колистину (mcr-1), тетрациклину (tetA) и бета-лактамным антибиотикам (blaSHV, ampC).
Отобранные праймеры предполагают поиск различных механизмов лекарственной устойчивости: изменение мишени антибиотика (gyrA, gyrB, parC, parE, mcr-1), инактивацию антибиотика (blaSHV, ampC), эффлюкс-насос (tetA).
Параллельно была оценена антибиотикоустойчивость микроорганизмов методом серийных разведений. Прижизненно были отобраны пробы фекалий от трех птиц каждой группы на 5-е и 31-е сутки и произведены посевы на среды Эндо (НПО «Микроген», Россия), MRS-агар (Condalab, Испания), энтерококк-агар (Condalab, Испания) как без добавления антибиотика, так и с добавлением антибиотика в лечебной дозировке, рекомендованной производителем, а также в двукратной дозировке. Статистическую обработку данных производили с помощью программы MS Excel 97-2003 (США). Результаты представлены как средняя арифметическая (M) и стандартные ошибки средних (±SEM). Достоверность различий устанавливали по t-критерию Стьюдента, различия считали статистически значимыми при р ≥ 0.95.
Результаты и обсуждение
В эксперименте по изучению влияния рациона на развитие антибиотикоустойчивости микроорганизмов у цыплят-бройлеров показано развитие лекарственной устойчивости микробиома в ответ на выпойку ветеринарных антибиотиков.
Динамика генов антибиотикорезистентности представлена в таблицах 2а, 2б, 4а, 4б.
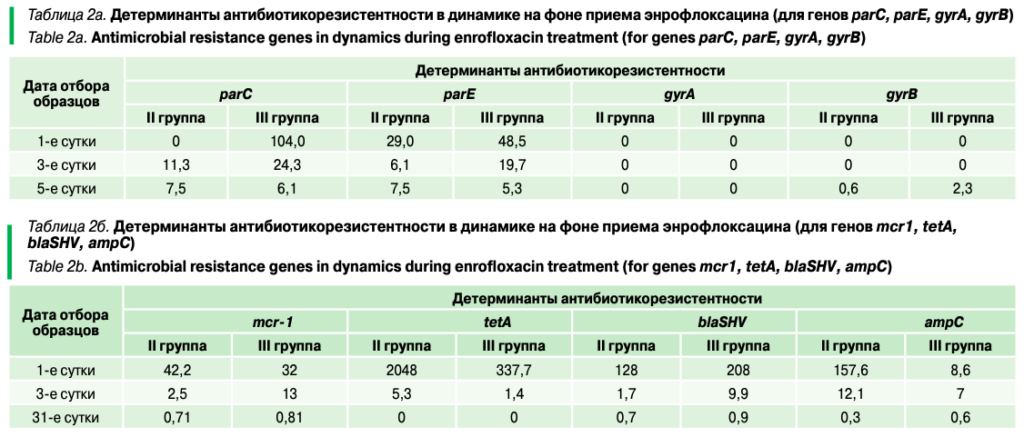
Можно отметить волнообразный характер динамики детерминант антибиотикорезистентности: всплеск на 1-е сутки приема (по генам tetA, blaSHV, ampC), затем снижение уровня антибиотикоустойчивости. Далее (на 29-е, 31-е сутки) умеренное превышение количества генов антибиотикоустойчивости по сравнению с уровнем контрольной группы.
В первые пять суток жизни цыплята II–III опытных групп получали энрофлоксацин, поэтому рост количества детерминант устойчивости к хинолоновым препаратам (гены parC и parE) представляется естественным.
Вызывает интерес резкий рост количества детерминант антибиотикоустойчивости tetA (устойчивость к тетрациклину), достигшего более чем 1000-кратного превышения относительно уровня контроля. Схожие результаты были продемонстрированы ранее в эксперименте на бычках. В результате приема энрофлоксацина наблюдалось повышение уровня гена tetA в фекалиях бычков опытной группы по сравнению с уровнем контрольной группы в десятки раз.
Резкий рост количества детерминант устойчивости ampC, управляющих бета-лактамазами и кодирующих устойчивость к цефалоспоринам I и II поколения, был отмечен на 1-е и 5-е сутки приема энрофлоксацина. В те же даты возрастало количество генов blaSHV, ответственных за синтез бета-лактамаз расширенного спектра.
Известно, что выделенные из внутренних органов сельскохозяйственной птицы кишечные палочки обладали множественной лекарственной устойчивостью практически ко всем антимикробным препаратам, разрешенным для применения в ветеринарии. Результаты бразильских исследователей демонстрируют широчайшее разнообразие молекулярных механизмов лекарственной устойчивости изолятов, выделенных из мяса птицы. Тем не менее слабо раскрыт характер возникновения лекарственной устойчивости под действием конкретного антибиотика у птицы.
Авторы наблюдали развитие кросс-резистентности к бета-лактамным антибиотикам в результате приема энрофлоксацина. В последние годы от птиц часто выделяют кишечные палочки, продуцирующие бета-лактамазы. Возможно, это связано с тем, что в результате широкого применения хинолоновых препаратов (прежде всего энрофлоксацина и ципрофлоксацина) происходит развитие устойчивости к бета-лактамным антибиотикам, что приводит к снижению их эффективности.
На взгляд авторов, важным наблюдением является то, что прием энрофлоксацина в 1–5-е сутки приводил к росту антибиотикорезистентности к колистину (по гену mcr-1). Ранее сообщалось, что практически все изоляты грамотрицательных микроорганизмов, выделенных от птицы, обладали перекрестной устойчивостью к колистину и фторхинолоновым препаратам, кодируемой, соответственно, генами mcr-1и gyrA, parC. Этот факт может иметь значение для практики птицеводства, так как энрофлоксацин и колистин входят в число часто применяемых антибактериальных препаратов в птицеводстве. Так, в России зарегистрированы 14 ветеринарных препаратов в виде смеси энрофлоксацина и колистина.
Таким образом, желаемый эффект от совместного применения этих антибиотиков может быть не достигнут из-за развития перекрестной антибиотикоустойчивости.
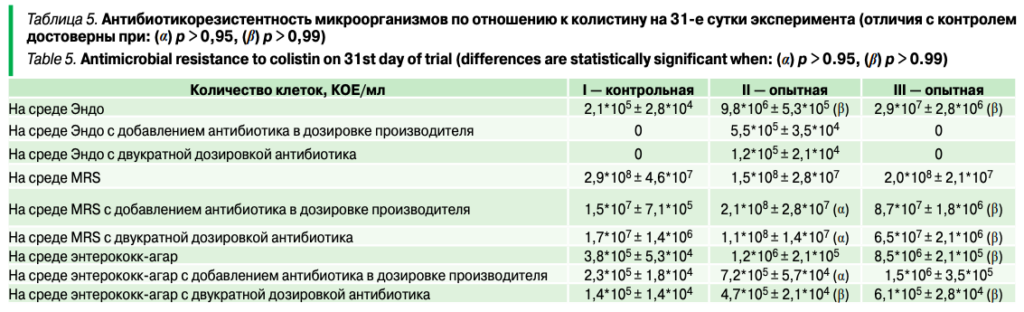
Результаты микробиологических посевов на селективных средах на 5-е сутки эксперимента представлены в таблице 3.
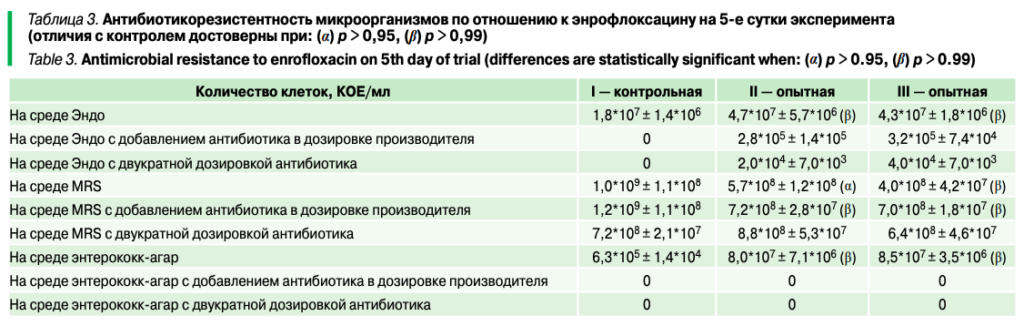
Выпойка энрофлоксацина привела к развитию антибиотикоустойчивых энтеробактерий в содержимом кишечника птиц. По всей видимости, выпойка энрофлоксацина оказывала незначительное влияние на содержание молочнокислых бактерий: при культивировании на MRS-агаре микроорганизмов из проб от II и III групп наблюдалось снижение их количества на полпорядка.
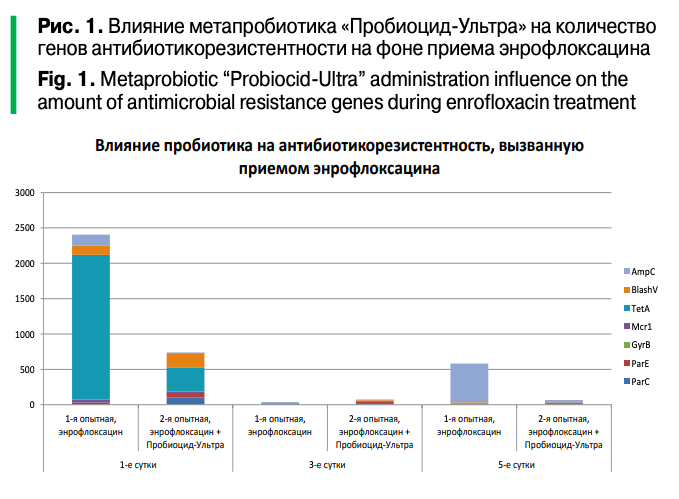
Прием метапробиотика «Пробиоцид-Ультра» соответствовал сокращению количества генов антибиотикорезистентности. Можно видеть, что на фоне приема энрофлоксацина (рис. 1) прием метапробиотика «Пробиоцид-Ультра» способствовал резкому сокращению антибиотикоустойчивости микробиома птиц, причем наибольшее сокращение достигнуто по генам ampC и tetA.
В план эксперимента была включена двукратная антибиотикотерапия. Результаты оценки антибиотикоустойчивости микроорганизмов представлены в таблицах 4а, 4б, 5.
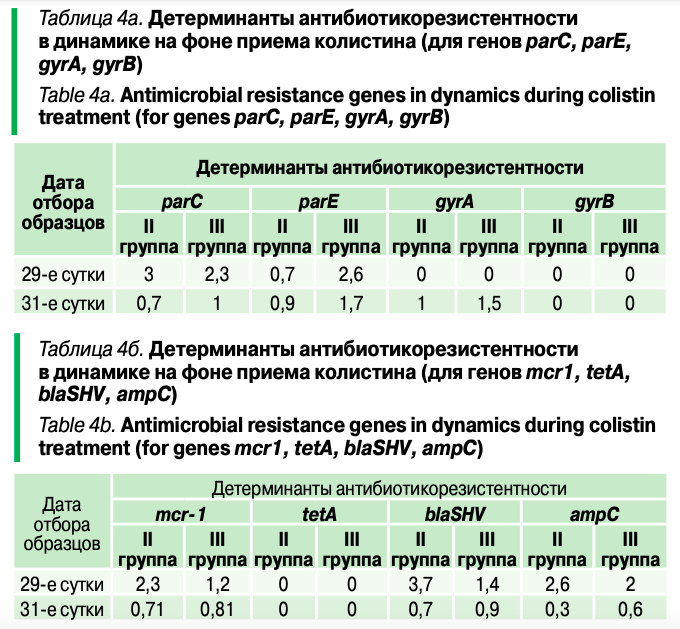
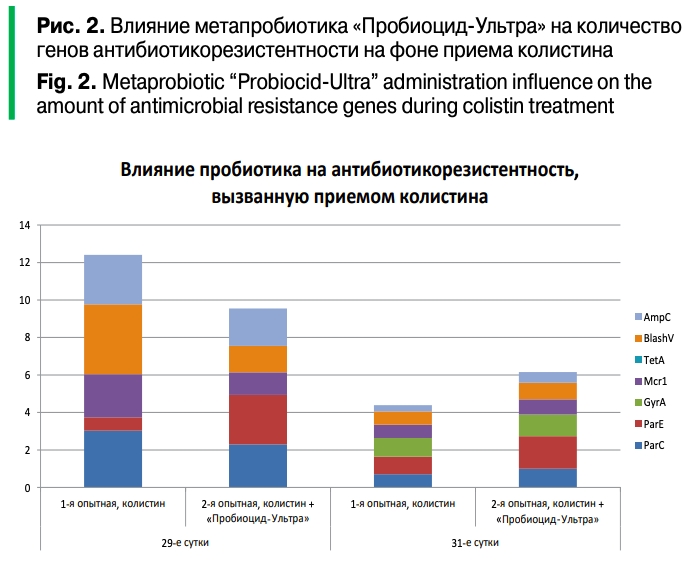
Отметим, что под влиянием приема колистина наблюдался рост устойчивости к энрофлоксацину (по генам parC, parE), к самому колистину (mcr-1), а также к бета-лактамным актибиоткам (blaSHV, ampC). Добавление метапробиотика «Пробиоцил-Ультра» оказывало разнонаправленное влияние на развитие антибиотикорезистентности (рис. 2).
Результаты посевов на среды представлены в таблице 5. Прием колистина способствовал развитию устойчивых к колистину энтробактерий во II группе, при этом под влиянием приема метапробиотика «Пробиоцид-Ультра» наблюдалось отсутствие антибиотикоустойчивых мутантов.
С практической точки зрения это может свидетельствовать о восстановлении чувствительности энтеробактерий к антибиотику при приеме пробиотика. Возможно, восстановление чувствительности микроорганизмов к антибиотику может быть одним из факторов, раскрывающим положительное действие пробиотических препаратов на зоотехнические и ветеринарные показатели выращивания птиц.
Сравнение результатов оценки развития антибиотикорезистентности на фоне приема пробиотика, выполненных с помощью классических методов микробиологии и молекулярно-генетическими методами, показывает ограниченность использованных средств.
С одной стороны, в распоряжении был ограниченный набор праймеров, которые не могли охватить все молекулярные механизмы устойчивости к антибиотикам, с другой — ограниченный набор микробиологических сред и антибиотиков не способствовал всесторонней оценке резистома. Тем не менее удалось показать как развитие антибиотикорезистентности микробиома под влиянием приема энрофлоксацина (табл. 2а, 2б, 3) и колистина (табл. 4а, 4б, 5), так и ее снижение под действием метапробиотика «Пробиоцид-Ультра» (рис. 1, табл. 5).
На взгляд авторов, восстановление чувствительности микробиома к антибиотикам в результате интродукции пробиотических штаммов микроорганизмов может иметь важное значение для практики птицеводства, поскольку фактически восстанавливает активность антибиотиков.
Существуют свидетельства о влиянии пробиотиков на снижение количества антибиотикоустойчивых форм патогенных микроорганизмов. Так, выпойка пробиотика цыплятам-бройлерам способствовала сокращению количества кишечных палочек, продуцирующих бета-лактамазы расширенного спектра, сокращению факторов вирулентности. Было показано, что интродукция in ovo пробиотического штамма Lactobacillus rhamnosus способствует сокращению устойчивости патогенных микроорганизмов к аминогликозидам и триметоприму.
Одним из механизмов антибиотикорезистентности может быть активизация реконструкции ДНК клеток-мишеней, мутагенеза и горизонтальной передачи генов под действием антимикробного агента, входящая в комплекс SOS-ответа. Было показано, что метаболиты пробиотических штаммов бацилл снижают SOS-ответ микроорганизмов под действием антибиотиков. В частности, некоторые ингибиторы SOS-ответа снижают способности бактерий к приобретению устойчивости к антибиотикам и уменьшают частоту переноса плазмид, усиливают бактерицидное действие антибиотика.
Пробиотики достаточно давно известны как средство контроля за распространением антибиотикоустойчивых микроорганизмов. Однако механизмы этого процесса пока не вполне ясны. Вероятно, общее сокращение количества генов антибиотикоустойчивости может быть связано с возрастанием биоразнообразия под влиянием пробиотика, а также с сокращением количества микроорганизмов — носителей генов резистентности.
Кроме того, некоторые метаболиты пробиотических микроорганизмов показывают способность к повышению чувствительности патогенных бактерий к антимикробным препаратам путем ингибирования SOS-ответа.
Выводы
Была продемонстрирована динамика количества генов антибиотикоустойивости микроорганизмов в результате выпойки цыплятам-бройлерам ветеринарных антибиотиков энрофлоксацина и колистина. Под действием энрофлоксацина происходило накопление детерминант антибиотикорезистентности к самому энрофлоксацину, а также к бета-лактамным антибиотикам, тетрациклину и колистину. Под действием колистина увеличивалось количество генов устойчивости к энрофлоксацину, колистину и бета-лактамным антибиотикам. Добавление в корм птице метапробиотика «Пробицид-Ультра» способствовало заметному снижению количества генов антибиотикоустойчивости, а при высеве на среды приводило к исчезновению антибиотикоустойчивых к колистину энтеробактерий.
Об авторах
Дарья Георгиевна Тюрина, кандидат экономических наук
tiurina@biotrof.ru; https://orcid.org/0000-0001-9001-2432
Елена Павловна Горфункель, ветеринарный контролер
elena@biotrof.ru; https://orcid.org/0000-0002-6843-8733
Валентина Анатольевна Филиппова, биотехнолог
filippova@biotrof.ru; https://orcid.org/0000-0001-8789-9837
Георгий Юрьевич Лаптев, доктор биологических наук
laptev@biotrof.ru; https://orcid.org/0000-0002-8795-6659
Наталья Ивановна Новикова, кандидат биологических наук
novikova@biotrof.ru; https://orcid.org/0000-0002-9647-4184
Елена Александровна Йылдырым, доктор биологических наук
deniz@biotrof.ru; https://orcid.org/0000-0002-5846-5105
Лариса Александровна Ильина, доктор биологических наук
ilina@biotrof.ru; https://orcid.org/0000-0003-2789-4844
Андрей Валерьевич Дубровин, кандидат ветеринарных наук
dubrovin@biotrof.ru; https://orcid.org/0000-0001-8424-4114
Алиса Сергеевна Дубровина, биотехнолог
dasvet@biotrof.ru; https://orcid.org/0000-0002-4336-8273
Ксения Андреевна Калиткина, биотехнолог
ksenya.k.a@biotrof.ru; https://orcid.org/0000-0002-9541-6839
Василий Александрович Заикин, биотехнолог
dfcx@biotrof.ru; https://orcid.org/0009-0006-8029-9955
Екатерина Сергеевна Пономарева, биотехнолог
kate@biotrof.ru; https://orcid.org/0000-0002-4336-8273
Алеся Анисовна Савичева, технолог
sava@biotrof.ru; https://orcid.org/0009-0007-9125-8005
Наталия Сергеевна Патюкова, технолог
nap@biotrof.ru; https://orcid.org/0009-0002-0948-7479
ООО «БИОТРОФ», ул. Малиновская, 8А, пом. 7-Н, Пушкин, Санкт-Петербург, 196602, Россия
УДК 579.64:636.087.8:636.5.033
DOI: 10.32634/0869-8155-2024-380-3-85-91
Сельское хозяйство, ветеринария, зоотехния, агрономия, агроинженерия, пищевые технологии





















