Анализ взаимосвязи частоты встречаемости эритроцитов с микроядрами, качества семени и показателей воспроизводства при искусственном осеменении лисиц

Уровень воспроизводства в любой отрасли животноводства — один из основных критериев оценки успешности хозяйственной деятельности предприятия.
С целью систематического и своевременного получения потомства в хозяйствах различных отраслей животноводства применяются как классические способы и подходы воспроизводства, так и инновационные высокотехнологичные методы репродуктивной биотехнологии. Звероводческие предприятия, специализирующиеся на разведении клеточных пушных зверей и получении шкурковой продукции, не являются исключением и при проведении технологических мероприятий по воспроизводству (гон) используют не только классические подходы (спаривание), но и различные методы репродуктивной биотехнологии. Так, на звероводческих фермах, где разводят представителей семейства куньих, перед гоном или в его период для повышения количества щенят, индукции фолликулогенеза и овуляции у самок применяют различные гормональные препараты.
В хозяйствах, где специализируются на разведении песцов и лисиц, кроме гормональных обработок, применяют метод искусственного осеменения, который, как показывает практика, позволяет достичь хороших результатов.
По данным, полученным в работе японских исследователей, в течение нескольких сезонов воспроизводства при естественном спаривании показатели зачатия после одного, двух и трех случек составили 55,8%, 68,0% и 85,7% соответственно.
В то же время оплодотворяемость при искусственном осеменении составляла 82,4%, при этом средний размер помета — 3,7–4,3 щенка при естественном осеменении, 4,4 щенка — при искусственном осеменении.
В другой работе этих же исследователей при проведении искусственного осеменения рыжих лисиц замороженно-оттаянным семенем, собранным с использованием электроэякулятора, показатель оплодотворяемости был 81,3% (13 из 16 лисиц), при этом индекс жизнеспособности сперматозоидов составил 47 ± 3, расчетный индекс жизнеспособности после размораживания демонстрировал 72,3% восстановления.
Однако, несмотря на то что показатели применения репродуктивных биотехнологий и классического спаривания на фермах по разведению лисиц и песцов достигают хороших результатов, в различные сезоны воспроизводства отмечается непостоянство относительного количества успешно осемененных самок, размера помета и относительного количества благополучно рожденных и выживших щенят.
Установлено, что в разные годы исследования при искусственном осеменении относительное количество забеременевших самок было различным и составляло от 66,8 до 83,4%, при этом выход щенков на основную самку также был разным — от 3,4 ± 0,03 до 4,3 ± 0,003.
Имеются данные, свидетельствующие о том, что у самцов лисицы может встречаться до 20% сперматозоидов с различными аномалиями, что может оказывать влияние на показатели воспроизводства.
Загрязнение окружающей среды, применение антибиотиков и гормональных препаратов, качество корма и питьевой воды, различные метаболические нарушения оказывают негативное влияние на репродуктивные качества различных биологических объектов. Эти проявления требуют контролируемого подхода к подбору и отбору родительских особей, как при естественном спаривании, так и при выборе доноров спермопродукции, для проведения искусственного осеменения. Традиционным и доступным в практической работе способом оценки семени считается микроскопическое исследование эякулятов самцов-производителей. Также существует компьютерный метод исследования семени с помощью систем CASA (Computer Aided Sperm Analysis). Данный метод более точный, исключает фактор субъективности, но предполагает соблюдение определенных технических требований к получению, транспортировке, разбавлению семени.
В целях прогнозирования репродуктивного успеха при применении биотехнологических методов воспроизводства в животноводстве успешно используется такой биологический показатель, как частота встречаемости различных характеристик геномной нестабильности соматических клеток, ассоциированный с изменчивостью частот появления аномальных сперматозоидов. К таким показателям, в частности, относится количество эритроцитов с микроядрами, отражающее потенциальную геномную нестабильность доноров спермы.
Для того чтобы определить частоту встречаемости эритроцитов с микроядрами, в 1970 году был разработан микроядерный тест (МЯТ). Метод остается актуальным и сегодня, и с применением микроядерного теста на различных биологических моделях проводится внушительное количество исследований, направленных на выявление взаимосвязи частоты встречаемости эритроцитов с микроядрами и репродуктивными показателями.
Применяется метод оценки геномной нестабильности по характеристикам соматических клеток и с целью изучения возможной взаимосвязи между повышенной частотой встречаемости эритроцитов с микроядрами в периферической крови с аномалиями в сперматозоидах, бесплодием, невынашиванием беременности, преэклампсией и задержкой внутриутробного развития у человека.
Цель исследования — изучение взаимосвязи между показателями микроядерного теста, характеристиками эякулятов самцов лисицы и результатами искусственного осеменения лисиц их семенем для повышения успешности биотехнологических процедур по искусственному осеменению в зверохозяйствах.
Материалы и методы исследования
Образцы эякулятов, неокрашенные мазки крови, результаты искусственного осеменения для исследования были представлены кафедрой частной зоотехнии Московской государственной академии ветеринарной медицины и биотехнологии — МВА им. К.И. Скрябина.
Для проведения исследования использовали эякуляты, полученные от 16 голов 3–4-летних самцов серебристо-черной лисицы, а также мазки их периферической крови.
Семя отбирали методом мастурбации, далее отбирали 0,5–1,0 мл для исследования и разбавляли в пропорции 1:1 средой Galap (IMV, Франция). Оставшееся семя использовали для искусственного осеменения самок. Разбавленные образцы в течение пяти часов доставляли в лабораторию ветеринарной клиники РГАУ — МСХА им. К.А. Тимирязева для дальнейшей оценки их качества.
Концентрацию сперматозоидов (млн/мл) определяли методом фотометрии на приборе SDM-1 (Minitube, Германия).
Компьютерный анализ проводили на системе ISAS (Integrated Semen Analysis System, ISAS, Projected I Serveis R + D S.L., Испания).
Качество спермиев по типам движения и их процентному распределению в эякуляте: подвижные с быстрым поступательным движением — тип a, подвижные с медленным поступательным движением – тип b, подвижные с непоступательным движением (колебательное, маятникообразное, манежное) — тип c, неподвижные — тип d.
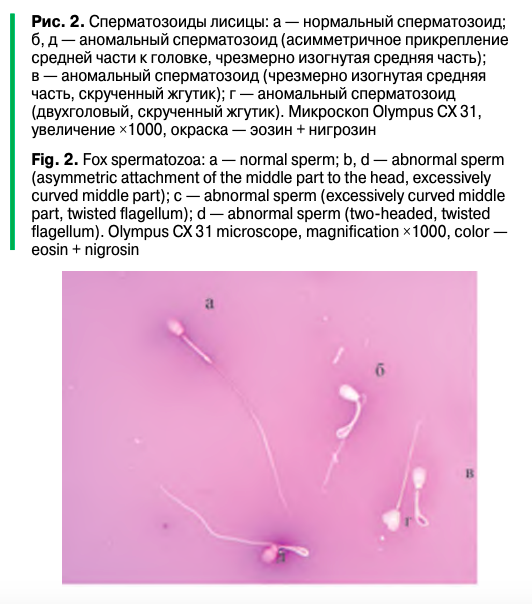
Морфологическую оценку сперматозоидов проводили с целью выявления, подсчета и определения процентного распределения нормальных и аномальных форм сперматозоидов в эякулятах. Для этого из эякулятов готовили мазки и проводили их оценку и подсчет сперматозоидов по методике, представленной в руководстве ВОЗ по исследованию и обработке эякулята человека.
Классификацию сперматозоидов проводили по принципу «нормальный — аномальный», при этом учитывали следующие дефекты:
- дефекты головки –— большая или маленькая, конусообразная, грушевидная, круглая, аморфная, вакуолизированная; двухголовый или любая комбинация вышеназванных дефектов;
- дефекты шейки и средней части — асимметричное прикрепление средней части к головке (гетероаксиальность), толстая или с неправильным контуром, чрезмерно изогнутая, аномально тонкая или любая комбинация названных характеристик;
- дефекты основной части жгутика — короткая, множественная, сломанная, шпилькообразная, с резко выраженным углом, ширина с неправильным контуром, скрученная или любая комбинация названных характеристик.
Для выполнения микроядерного теста были приготовлены цитогенетические препараты — мазки крови. Кровь брали методом срезания когтя на среднем пальце тазовой конечности. Мазки крови окрашивали по Романовскому — Гимзе. Подсчет эритроцитов с микроядрами проводили под микроскопом MIS-8000 (C&A Scientific Co Inc, Китай) с использованием иммерсионного объектива при увеличении x1000. В каждом препарате подсчитывалось количество эритроцитов, содержащих микроядра (ЭМЯ), в расчете на 3000 клеток по следующей формуле:
(Количество ЭМЯ) / 3000 × 100.
Частоту встречаемости эритроцитов с микроядрами выражали в промилле (‰). Процедуру искусственного осеменения проводили однократно разбавленным семенем в соотношении 1:3 в течение 2–3 часов после взятия эякулята. Для оценки эффективности процедуры искусственного осеменения учитывали: количество и процентное соотношение забеременевших и пропустовавших самок, а также количество рожденных живых и мертвых щенков.
Для выявления статистически зависимых показателей использовали коэффициент ранговой корреляции Спирмена.
Результаты и обсуждение
В результате исследований эякулятов, полученных от самцов лисицы, было установлено, что общая концентрация сперматозоидов в разбавленных (1:1) образцах имела различные значения и колебалась от 47 до 172 млн/мл (табл. 1).
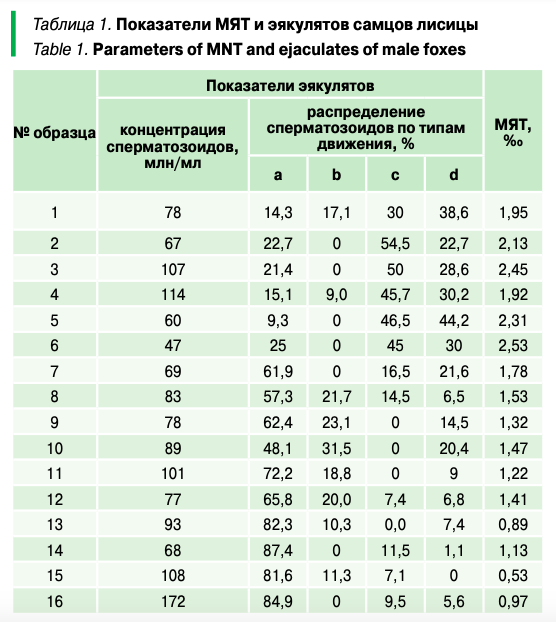
При этом было установлено, что степень влияния концентрации сперматозоидов в эякулятах самцов лисицы минимальна на результаты искусственного осеменения (ИО) и не имеет статистически значимых отличий. Так, высокая эффективность процедуры ИО лисиц отмечалась как при высокой концентрации сперматозоидов (образцы 15–100 млн/мл — 100% беременных самок, 16–172 млн/мл — 75% беременных самок), так и при средней (образцы 14–68 млн/мл и 12–70 млн/мл — 100% беременных самок), и, наоборот, при искусственном осеменении лисиц образцами с высокой концентрацией сперматозоидов в эякулятах забеременевших самок не отмечалось (3–107млн/мл; при осеменении образцом 4–114 млн/мл было только 33,3% забеременевших самок) (табл. 1, 2).
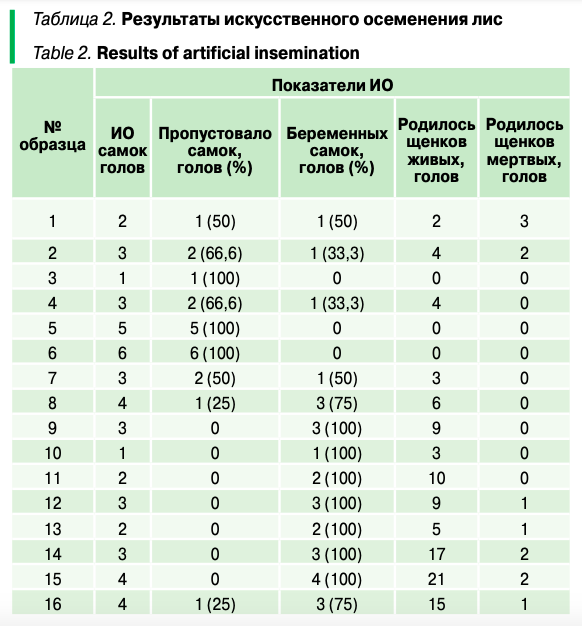
В то же время результаты искусственного осеменения лисиц и анализ на системе ISAS семени показывают, что одним из определяющих факторов успешности процедуры ИО было процентное распределение сперматозоидов по типу движения в эякулятах. Высокое процентное содержание в эякулятах сперматозоидов с типом движения a + b (более 50%) обеспечивало 100%-ный результат осеменения в семи случаях (образцы 9–15), 75% — в двух случаях (образцы 8 и 16), 50% — в одном случае (образец 7).
Необходимо отметить, что в образце 7 хотя и был высокий процент сперматозоидов с быстрым поступательным движением (тип a) (61,9%), но полностью отсутствовали сперматозоиды с медленным поступательным движением (тип b), определялось довольно высокое содержание сперматозоидов с непоступательным движением (колебательное, маятникообразное, манежное — тип c) — таких было 16,5%, а также неподвижных (тип d) — 21,6%.
В то же время образцы 1–6 имели низкое содержание сперматозоидов с быстрым поступательным движением (тип a), а сперматозоиды с медленным поступательным движением определялись только в эякулятах 1 и 4. Во всех образцах (с 1 по 6) отмечалось высокое содержание сперматозоидов с непоступательными движениями (тип c) и (или) неподвижных (тип d). Результаты искусственного осеменения этими эякулятами были низкие и составляли: максимум 50% — в одном случае (образец 1), 33,3% — в двух случаях (образцы 2 и 4), отсутствие беременности — в трех случаях (образцы 3, 5 и 6).
При проведении микроядерного теста установлено, что у самцов, эякуляты (образцы 1–6) которых показали низкие результаты при искусственном осеменении, частота встречаемости эритроцитов с микроядрами составила от 1,92 до 2,53‰. Частота встречаемости эритроцитов с микроядрами (рис. 1) в мазках крови превысила 2,0‰ в биообразцах животных 3–2,45‰, 5–2,31‰ и 6 2,53‰, сперма которых при искусственном осеменении не имела успеха, и только у образца 3—2,13‰ положительный результат искусственного осеменения был в одном случае из трех. В то же время самцы, эякуляты которых продемонстрировали высокие результаты искусственного осеменения, имели показатели микроядерного теста (МЯТ) ниже, и частота встречаемости эритроцитов с микроядрами составила от 0,53 до 1,53‰ (табл. 1, 2).
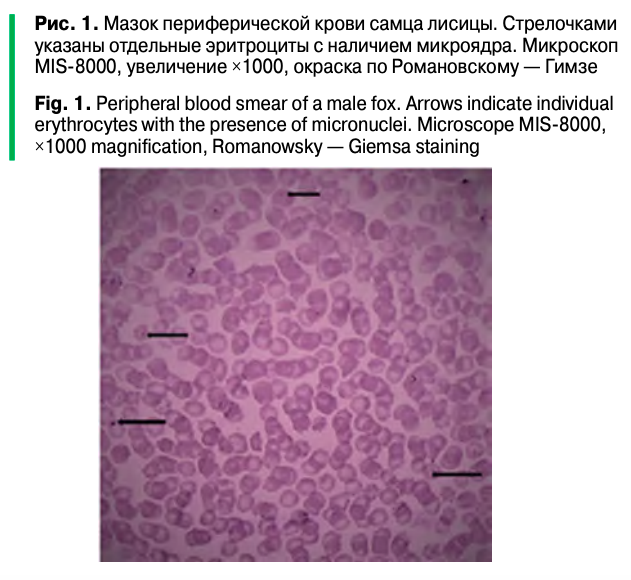
При оценке и выявлении морфологически нормальных и аномальных форм сперматозоидов в исследуемых образцах эякулятов были получены следующие значения (табл. 3). В образцах 1–6 морфологически нормальных сперматозоидов определялось не более 37% (образец 4), при этом, как было отмечено, показатели микроядерного теста у данных самцов имели высокие значения — от 1,92 до 2,53‰. В этих эякулятах преобладали аномальные формы сперматозоидов — от 63 до 83%. При этом была установлена прямая корреляция между повышением частоты встречаемости эритроцитов с микроядрами и повышением в эякулятах сперматозоидов с аномальными формами (p < 0,05).
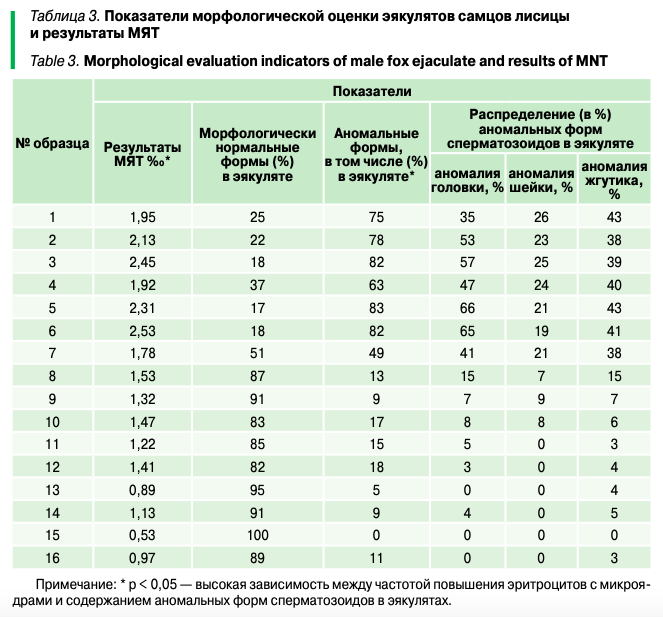
Распределение по видам аномальных форм сперматозоидов в этих образцах было неравномерным, и некоторые сперматозоиды имели множественные формы аномалий, то есть у одного и того же сперматозоида отмечались, например, и аномалия головки, и аномалия жгутика (рис. 2). Кроме того, прослеживалась тенденция, показывающая, что у самцов, в мазках крови которых частота встречаемости эритроцитов превышала 2‰, преобладали формы аномалий головки (образцы 3 — 2,13‰/53% сперматозоидов с аномалией головки, 3 — 2,45‰/57%, 5 — 2,31‰/66%, 6 — 2,53‰/65%). По частоте встречаемости среди аномалий преобладали сперматозоиды с измененными жгутиками по сравнению с аномальными формами шейки, в эякулятах таких сперматозоидов встречалось от 38 до 43%.
В образцах 7–16, где исследовались эякуляты самцов, у которых частота встречаемости эритроцитов с микроядрами не превышала 1,53‰, преобладали морфологически нормальные сперматозоиды, их относительное количество составляло от 82 до 100%. У трех образцов (13, 15 и 16) практически отсутствовали сперматозоиды с аномалиями головки и шейки.
Эякуляты, в которых преобладали сперматозоиды с типом движения a и b, показали хорошие результаты искусственного осеменения, данный показатель ассоциирован с фертильными качествами семени. В то же время в эякулятах с низкими оплодотворяющими способностями преобладали сперматозоиды с непоступательным движением (тип c) и неподвижные (тип d). Было установлено, что эякуляты с низкой оплодотворяющей способностью получены от самцов с высокими показателями МЯТ, частота встречаемости эритроцитов с микроядрами в мазках, приготовленных из периферической крови, взятой у этих самцов, превышала 2‰. Отмечено, что в этих эякулятах преобладали морфологически аномальные сперматозоиды и в процентном распределении встречаемости аномалий чаще встречались аномалии головки и жгутиков, что могло сказаться на оплодотворяющей способности сперматозоидов и их подвижности.
Выводы
- Концентрация сперматозоидов в эякулятах самцов лисицы не оказывала существенного влияния на результаты искусственного осеменения, 75–100%-ная оплодотворяемость отмечалась как при высокой концентрации (172 млн/мл), так и при средней (68 млн/мл).
- Высокое процентное содержание в эякулятах сперматозоидов с типом движения a + b (более 50%) обеспечивало 100%-ный положительный результат искусственного осеменения лисиц;
- Выявлена высокая зависимость (p < 0,05) между частотой повышения эритроцитов с микроядрами и содержанием аномальных форм сперматозоидов в эякулятах.
- Установлено, что эякуляты с низкой оплодотворяющей способностью получены от самцов с высокими показателями МЯТ, частота встречаемости эритроцитов с микроядрами в мазках, приготовленных из периферической крови, взятой у этих самцов, превышала 2‰.
Об авторах
Дмитрий Владимирович Попов1, кандидат биологических наук
popov.bio@gmail.com; https://orcid.org/0000-0001-7422-5470
Татьяна Теодоровна Глазко1, доктор сельскохозяйственных наук, профессор
https://orcid.org/0000-0002-3879-6935
Валерий Иванович Глазко1, доктор сельскохозяйственных наук, профессор, академик Российской академии наук (иностранный член)
https://orcid.org/0000-0002-8566-8717
Елена Евгеньевна Ларина2, кандидат сельскохозяйственных наук
https://orcid.org/ 0000-0002-4734-5773
Евгения Сергеевна Седлецкая3, кандидат ветеринарных наук
https://orcid.org/0000-0002-4798-8971
Глеб Юрьевич Косовский1, доктор биологических наук, член-корреспондент Российской академии наук
https://orcid.org/0000-0003-3808-3086
1Научно-исследовательский институт пушного звероводства и кролиководства им. В.А. Афанасьева, ул. Трудовая, 6, пос. Родники, Раменский р-н, Московская обл., 140143, Россия
2Московская государственная академия ветеринарной медицины и биотехнологии — МВА им. К.И. Скрябина, ул. Академика Скрябина, 23, Москва, 109472, Россия
3Российский государственный аграрный университет — Московская сельскохозяйственная академия им. К.А. Тимирязева, ул. Тимирязевская, 49, Москва, 127550, Россия
УДК 636.082.453.52; 636.934.22 DOI: 10.32634/0869-8155-2024-378-1-86-91
Сельское хозяйство, ветеринария, зоотехния, агрономия, агроинженерия, пищевые технологии





















