Иммунологический статус свиноматок в ходе репродуктивного цикла и коррекция его состояния биостимулятором антигенонаправленного действия

Воспроизводство стада — одно из важнейших направлений деятельности современных свиноводческих предприятий, влияющих на экономическую эффективность его работы. Оно базируется на технологии получения поросят в планируемые сроки, что возможно при строгой регуляции репродуктивных функций свиноматок и воспроизводительного процесса в целом.
Свиноматки, используемые в товарном производстве, обладают повышенной репродуктивной способностью благодаря генетическим достижениям. Однако увеличение размера помета повлияло не только на количество и вес поросят при рождении, но и на процесс их внутриутробного развития, что в последующем определяет показатели их роста и сохранности. В этих условиях поддержание иммунного статуса свиноматок важно не только для сохранения «собственного» здоровья, но и возможности получения здорового потомства.
Согласно данным, решающее значение в формировании репродуктивного потенциала свиноматок имеет достаточное потребление энергии и меньшее количество воздействующих на их организм инфекционных агентов. Поэтому важно в промышленной среде создать такие технологические условия, которые способствовали бы сохранению иммунного ответа организма свиноматок на воздействие антигенных агентов в различные сроки репродуктивного цикла. При этом необходимо контролировать распространенность «факторных инфекций», которые инициируют нарушение воспроизводительных функций у свиноматок.
Одним из экономически важных вирусов в свиноводческих предприятиях является цирковирус ЦВС-2, заболеваемость животных которым контролирует (но не устраняет) вакцинация. Это определяется особенностью персистенции вируса в окружающей среде свиноводческих помещений и отсутствием «стерилизующего иммунитета» после вакцинации. По данным, частота положительных результатов на цирковирус значительно выше у свиноматок с репродуктивной недостаточностью, чем у здоровых, при этом более 60,60% абортированных плодов положительны по цирковирусу. Свиноматки с клиническими признаками цирковирусной инфекции не только имеют хронические репродуктивные проблемы, но и более низкий уровень оплодотворяемости и более высокий средний уровень смертности. Типичным клиническим признаком репродуктивной недостаточности свиноматок, связанной с ЦВС-2, является наличие мертворожденных поросят в помете. В работе констатировано, что наличие в помете свиноматок хотя бы одного мертворожденного поросенка сочетается с идентификцией в пробах их крови генома цирковируса. На тяжесть репродуктивной недостаточности влияет не только вирулентность штамма вируса, но и стадия беременности.
Поскольку репродуктивная недостаточность свиноматок, ассоциированная с цирковирусной инфекцией, широко распространена в свиноводческих предприятиях, целью исследования явилась оценка иммунного статуса свиноматок после вакцинации против ЦВС-2 в ходе последующего репродуктивного цикла, а также при коррекции его состояния за счет повышения эффективности иммунного ответа организма животных после вакцинации.
Материалы и методы исследования
Эксперимент выполнен в условиях товарного свинокомплекса ООО «Агрофирма Ариант» в 2022–2023 гг. (Челябинская обл., Россия), на котором технология производства свинины основана с учетом рекомендаций Genesis и региональных характеристик предприятия.
При планировании экспериментальной части работы учитывали полную технологическую схему использования свиноматок в условиях поточной системы воспроизводства, которая предусматривала холостой период, определяемый временем на синхронизацию и осеменение свиноматок, супоросный период, и подготовку к опоросу, а также опорос и лактационный период.
На предприятии используется короткий цикл воспроизводства, в котором период подсоса составляет 21 день, и время содержания свиноматок до осеменения после отъема (7–10 суток).
Питательность рациона кормления и перемещение животных по специализированным помещениям регулировались в соответствии с данной схемой. При этом для кормления свиноматок на предприятии используется жидкий корм (режим кормления — двухкратный). Животные имеют свободный доступ к автоматическим поилкам.
Свиноматок в холостой период и большую часть супоросного периода содержали групповым методом, а в последнюю треть супоросности, включая опорос и лактационный (подсосный) период — в индивидуальных боксах. За неделю до предполагаемой даты родов свиноматок переводили в сектор опороса.
В период проведения эксперимента общее поголовье свиноматок варьировало в пределах 196–202 голов и состояло из основных и проверяемых маток.
Дизайн экспериментальной части работы учитывал схему вакцинации животных против цирковирусной инфекции, которая проводилась в конце подсосного периода при отъеме поросят, то есть на 21-е сутки после родов. Для этих целей использовалась вакцина «Ингельвак ЦиркоФЛЕКС» (Германия). После вакцинации состояние свиноматок визуально контролировали на наличие побочных реакций в течение двух часов.
Исследовательская часть работы выполнена в два этапа (рис. 1).
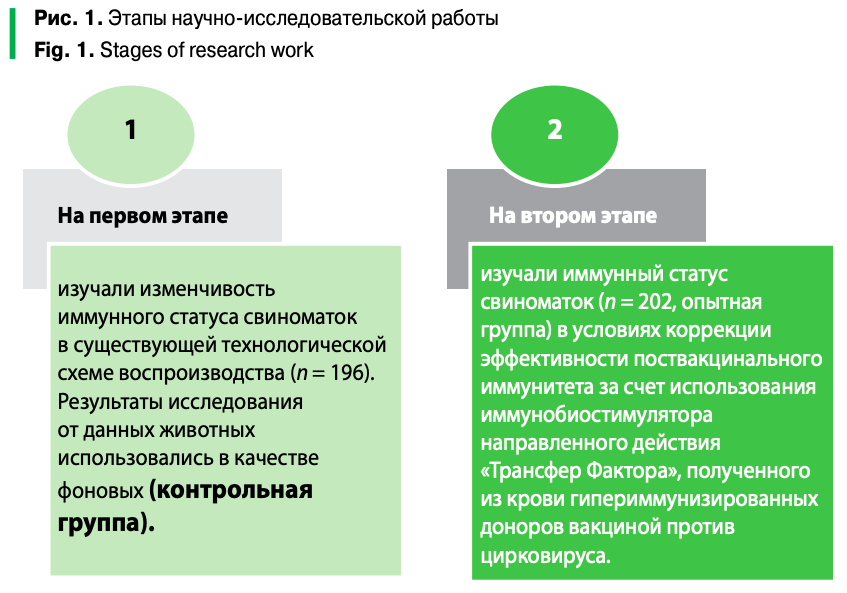
Перед использованием препарат подвергался стандартной проверке на стерильность. «Трансфер Фактор» вводили свиноматкам двукратно с интервалом 7 дней в дозе 5 мл на одну голову. Второе введение «Трансфер Фактора» сочетали с использованием вакцины против цирковируса.
Иммунный статус свиноматок характеризовали на основе исследования образцов крови, которые на каждом этапе эксперимента методом случайной выборки брали у 10 голов венепункцией краниальной полой вены в следующие сроки технологического цикла:
1) до первого введения «Трансфер Фактора» (14-сутки после опороса);
2) в середине супоросности (57–59-е сутки беременности);
3) в конце беременности (до перевода в секцию опороса).
От каждой свиноматки брали по 2 пробирки крови, которые в термоконтейнере доставлялись в ООО «Леан» (Троицк, Челябинская обл., Россия , Договор № 98/223 от 08.08.2022 г.) для проведения последующих исследований. В образцах крови определяли концентрацию иммуноглобулинов А (IgA), G (IgG), М (IgM) иммунотурбидиметрическим методом на биохимическом анализаторе Gobas 6000 (Roche Diagnostics, Швейцария).
Методом проточной цитометрии в 109/л и % определяли количество: Т-лимфоцитов (CD3 + CD19-); Т-хелперов/индукторов (CD3 + CD4 + CD45+); Т-цитотоксических лимфоцитов (Т-ЦТЛ) (CD3 + CD8 + CD45+); Т-лимфоцитов, экспрессирующих маркеры NK-клеток (Т-NK-клетки) (CD3 + CD56 + CD45+); истинных натуральных киллеров (NK-клетки) (CD3-CD56 + CD45+); NK-клеток, экспрессирующих альфа-цепь антигена CD8 (CD3-СD8 + CD45+) и В-лимфоциты (CD19 + CD3-).
Дополнительно были вычислены процентная доля незрелых Т-лимфоцитов (CD4 + CD8 + CD45+) и индекс CD3 + CD4+ / CD3 + CD8+ (Т-хелперы/ЦТЛ).
В качестве индикатора эффективности вакцинации определены уровень мертворожденности поросят и выход поросят на один опорос у свиноматок опытной и контрольной групп (по данным статистической отчетности свинокомплекса).
Полученный цифровой материал подвергли статистической обработке, используя возможности пакета программы Exel 2010 (США). Результаты выражены в виде средних значений и средних значений стандартной ошибки. Значения вероятности < 0,05 рассматривались как указывающие на значимость.
Результаты и обсуждение
Иммуноглобулины в организме свиноматок обеспечивают формирование и поддержание не только собственного иммунитета, но и защиту развивающихся плодов от антигенных раздражителей за счет эпителиохориальной функции плаценты и эффективность колострального иммунитета у подсосных поросят.
В организме свиноматок развитие поствакцинального иммунного ответа к цирковирусной инфекции протекает на фоне прогрессирования беременности и возрастания антигенной активности плода, а также прессинга факторов окружающей среды, что отражается на эффективности формируемого иммунитета. Соответственно, совокупность данных факторов влияет на изменчивость иммуноглобулинов в крови животных, формирующих гуморальные иммунологические механизмы в их организме. Поэтому вариабельность иммуноглобулинов G, M и А в крови свиноматок контрольной группы можно рассматривать как реакцию животных на вакцинацию в существующих условиях репродуктивного цикла.
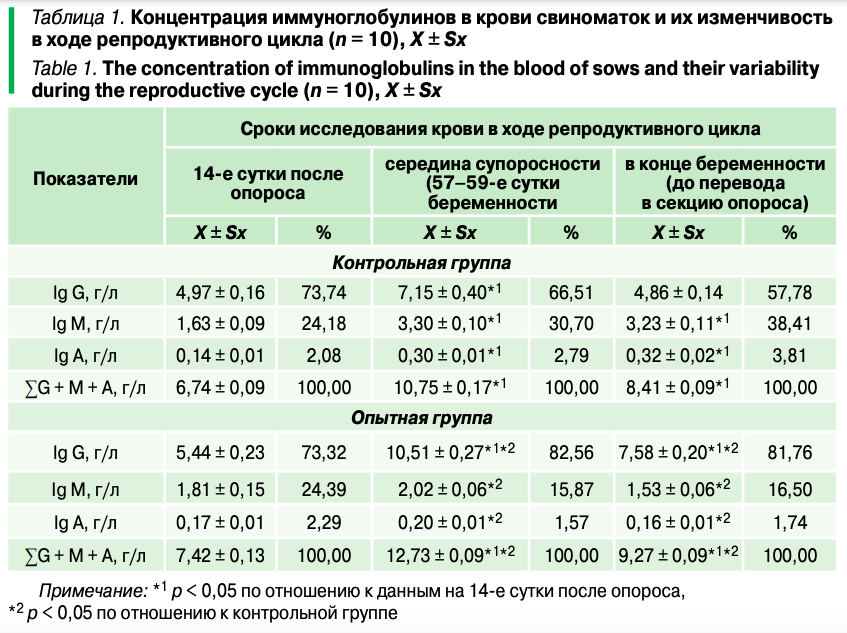
Свиноматки контрольной и опытной групп на 14-е сутки после опороса не имели статистически значимых различий в концентрации иммуноглобулинов в крови (табл. 1). При этом в их совокупности преобладали иммуноглобулины класса G (73,32–73,74% от их общей суммы), определяя способность белков как защищать организм матери от воздействия различных антигенов, так и поддерживать «иммунный фон» секрета молочных желез в ходе лактации. Согласно данным, большая часть иммуноглобулинов G молока — это сывороточные антитела, обладающие более высокой степенью усвоения в организме поросят.
Формирование поствакцинального иммунитета к цирковирусной инфекции у свиноматок протекало в условиях осеменения и последующего развития беременности. С одной стороны, вакцинация стимулировала адаптивный иммунный ответ организма, с другой — развитие плода, обладающего антигенной активностью, происходит только при иммунологической толерантности организма матери к антигенам плода. Поэтому состояние гуморального звена иммунитета, оцениваемого по концентрации иммуноглобулинов в крови матери, являлось «компромиссом» между данными иммунологическими процессами.
В середине супоросности у свиноматок контрольной группы, как результат циркуляции в крови поствакцинальных антител, достоверно возрастало количество иммуноглобулинов G, M и A (по сравнению с подсосными животными) в 1,44, 2,02 и 2,14 раза (табл. 1). Однако в общей сумме иммуноглобулинов уменьшалась доля IgG (до 66,51%) и возрастала IgM (до 30,70%).
Совокупность полученных данных можно расценивать как способность организма супоросных свиноматок не только адекватно отвечать на антигенную стимуляцию плода и противовирусной вакцины, но и вырабатывать антитела, связывающие антигены вирусного и бактериального происхождения, воздействующие на их организм в существующей технологической среде, то есть иммуноглобулиновый профиль крови свиноматок свидетельствовал о протекании в их организме процессов по механизму первичного и вторичного иммунного ответа.
В конце беременности у свиноматок контрольной группы в условиях общего снижения количества иммуноглобулинов в крови до 8,41 ± 0,09 г/л сохранялась тенденция изменений его классов, выявленная в середине супоросности (табл. 1). При этом уменьшалась концентрация IgG (до 4,86 ± 0,14 г/л), составляя в общей сумме иммунных белков 57,78%, что, по данным, является, вероятно, результатом их перехода через плаценту в плод в данный срок беременности, а также увеличивались количество IgM и IgA, соответственно, до 3,23 ± 0,11 г/л и 0,32 ± 0,02 г/л и их доля в сумме иммуноглобулинов до 38,41% и 3,81%, отражая состояние иммунологических механизмов в барьерах слизистых оболочек в организме животных.
В опытной группе свиноматок, у которых вакцинация сочеталась с введением специфического иммунобиостимулятора направленного действия, динамика иммуноглобулинов (рис. 2) в поствакцинальный период имела следующие особенности:

Для проверки данных выводов была изучена изменчивость лимфоцитарного состава крови свиноматок контрольной и опытной групп.
Как известно, лимфоциты являются специализированными клетками иммунной системы, способными быстро реагировать на сигналы чужеродных патогенов или воспалительных раздражителей. Среди них основными являются: 1) Т-лимфоциты, или Т-клетки («стражи» адаптивной иммунной системы), которые в ответ на антиген-специфические сигналы экспрессируют Т-клеточный рецептор (CD3), позволяя выявлять и устранять антигенную «угрозу» в организме животных; 2) В-лимфоциты, или В-клетки (факторы гуморальной иммунной системы), продуцирующие иммуноглобулины. При этом роль Т-лимфоцитов приоритетна в контроле состояния иммунной системы, а В-лимфоцитов — в секреции антител.
В настоящее время для дифференциации Т- и В-лимфоцитов используется метод проточной цитометрии, при котором Т-лимфоциты идентифицируются по экспрессии CD3, а В-лимфоциты — CD19-антигенов.
В стандартных технологических условиях лимфоцитарный профиль крови свиноматок опытной и контрольной групп на 14-е сутки после опороса не имел статистически значимых различий (табл. 2).
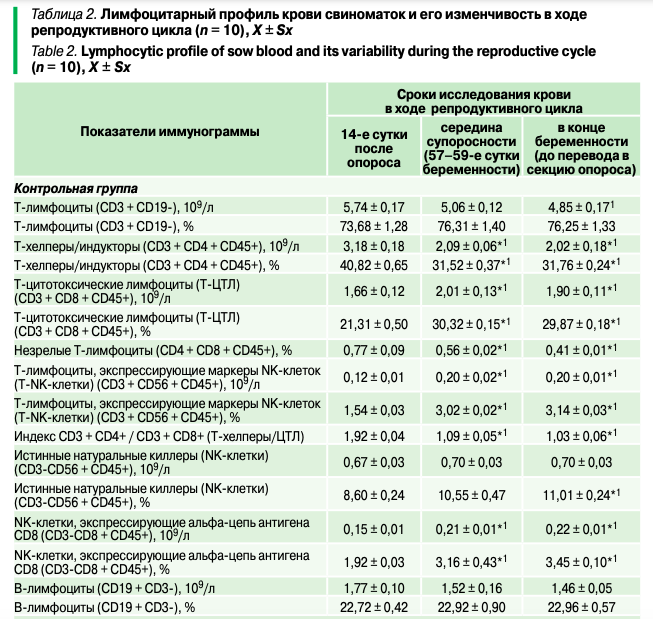
Так, лимфоциты в циркуляторном русле животных были представлены в основном Т-лимфоцитами, процентная доля которых составляла 73,68–76,31% (табл. 2). Количество В-лимфоцитов колебалось в интервале 1,60 ± 0,06 — 1,77 ± 0,10 109/л (21,65–22,72%). Субпопуляция Т-лимфоцитов как представителей адаптивной иммунной системы представлена на рисунке 3.

Таким образом, иммунный статус свиноматок в лактационный период до вакцинации поддерживался за счет функционирования лимфоцитов и их субпопуляций, обладающих специфическими свойствами и контролирующих состояние клеточного и гуморального иммунного ответа. Хотя Т-лимфоциты отвечают за синтез специфических цитокининов, а В-лимфоциты — за синтез иммуноглобулинов, выбор синтезируемых иммуноглобулинов и, соответственно, их уровень в крови сопряжены с секреторной активностью различных субпопуляций Т-лимфоцитов.
Динамические взаимодействия между В- и Т-клетками лежат в основе развития адаптивных гуморальных иммунных ответов — как в физиологических условиях, так и при вакцинации.
Уже было отмечено, что формирование поствакцинального иммунитета в организме свиноматок происходило на фоне прогрессирования беременности, что, соответственно, отражалось на общем количестве лимфоцитов в кровотоке и их клеточных субпопуляциях. Так, в крови свиноматок контрольной группы в середине супоросности (по сравнению с подсосным периодом) уменьшалось, хотя и недостоверно, абсолютное количество Т- и В-лимфоцитов на 11,84% и 14,12% соответственно. Однако их процентная доля в общем пуле лимфоцитов сохранялась (табл. 2), отражая способность организма животных как синтезировать антитела, так и реагировать на воздействие антигенов различной природы. В то же время наблюдалось снижение уровня и процентной доли Т-хелперов/индукторов (CD3 + CD4 + CD45+) на 34,27% и 22,78%.
Как известно, Т-хелперы состоят из клеточных субпопуляций, синтезирующих цитокинины с антагонистическими свойствами и за счет этого регулирующие соотношение реакций клеточного и гуморального иммунного ответа. Нормальное развитие и функционирование плаценты возможны в условиях преобладающего синтеза цитокининов, ативирующих В-лимфоциты. Поэтому уменьшение количества Т-хелперов на фоне прироста уровня Т-цитотоксических лимфоцитов (Т-ЦТЛ) (CD3 + CD8 + CD45+), Т-лимфоцитов, экспрессирующих маркеры NK-клеток (Т-NK-клетки) (CD3 + CD56 + CD45+) и истинных натуральных киллеров (NK-клеток) (CD3-CD56 + CD45+) свидетельствует о нарушениях в формировании «гуморального иммунного ответа» в организме свиноматок, что, соответственно, отразится на нормальном развитии плодов.
Аналогичный лимфоцитарный профиль выявлялся у свиноматок контрольной группы и в конце беременности. Хотя процентная доля Т- и В-лимфоцитов в общем пуле клеток крови практически не отличалась от данных подсосных свиноматок, их абсолютное количество уменьшалось на 15,51% и 17,51% соответственно (табл. 2), создавая основу для убыли в кровотоке концентрации иммуноглобулинов (табл. 1). При этом уровень Т-хелперов/индукторов в иммунограмме крови свиноматок оставался на уровне 31,76%, а цитотоксических лимфоцитов и натуральных киллеров — возрастал (табл. 2).
Следовательно, формирование поствакцинального иммунитета к ЦВС-2 в организме свиноматок в ходе прогрессирования беременности определялось как иммунной толерантностью матери к плоду, так и активностью Т-хелперов, ориентированной на усиление цитотоксической активности лимфоцитов. Возможно, вирусные антигены, в том числе и плода, попадая в кровоток свиноматок, стимулировали синтез цитотоксических лимфоцитов и NK-клеток, что отражалось как на эффективности поствакцинального иммунитета, так и на развитии плода.
Одной из причин повышения количества цитотоксических лимфоцитов в крови свиноматок может являться и то, что они обладают способностью защищать организм от инфекционных агентов, активируя процессы фагоцитоза. При этом баланс субпопуляций Т-лимфоцитов, определяющий цитокининовый профиль организма, очень важен в формировании иммунного ответа и отличается пластичностью, соизмеримой с окружением клеток.
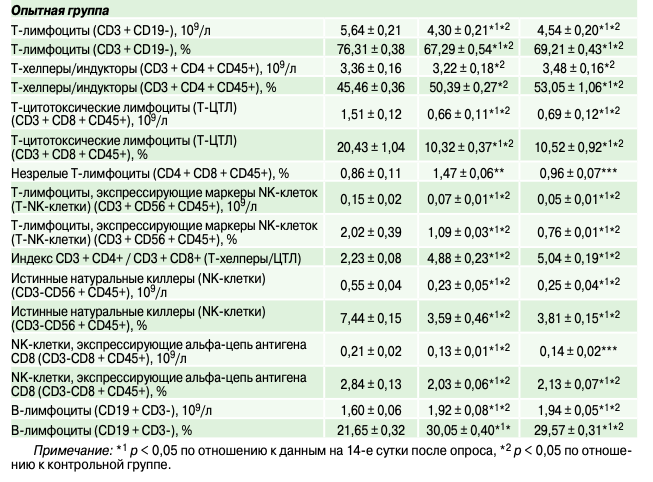
Условия вакцинации могут влиять на адаптивные иммунные реакции в организме супоросных свиноматок, определяя ее эффективность. Так, у животных опытной группы на фоне сочетания вакцинации с введением специфического иммунобиостимулятора направленного действия количество и процентная доля Т-лимфоцитов уменьшались (по сравнению с подсосным периодом) на 19,50–23,76% и 9,30–11,82% соответственно (табл. 2). При этом уровень В-лимфоцитов, наоборот, возрастал на 20,00–21,25%, определяя секреторную активность клеток, а также прирост уровня иммуноглобулинов в крови свиноматок в поствакцинальный период.
Кроме этого, значимы были различия и в количественной выраженности субпопуляций Т-лимфоцитов — как по отношению к контрольной группе, так и к подсосному периоду (табл. 2). Хотя абсолютное количество Т-хелперов/индукторов (CD3 + CD4 + CD45+) в иммунограмме свиноматок в поствакцинальный период статистически значимо не изменялось, их процентная доля в общем пуле лимфоцитов кровотока возрастала (на 10,84–16,69%). Это происходило на фоне уменьшения количества Т-цитотоксических лимфоцитов (Т-ЦТЛ) (CD3 + CD8 + CD45+), Т-лимфоцитов, экспрессирующих маркеры NK-клеток (Т-NK-клетки) (CD3+CD56+CD45+) и истинных натуральных киллеров (NK-клеток) (CD3-CD56+CD45+) в 2,14–3,00 раза, свидетельствуя о приоритетности формирования клеточного иммунного ответа в организме животных. По данным, это обеспечивало возможность сохранения и «более физиологического» развития беременности.
К аналогичным выводам в своих исследованиях пришли. Авторы отмечали, что в условиях переключения Th1-опосредованного клеточного ответа на Th2-опосредованный иммунный ответ создаются условия для нормального развития плода.
Таким образом, в опытной группе свиноматок прогрессирование беременности и формирование поствакцинального иммунитета протекали на фоне повышения процентной доли Т-хелперов, которые посредством синтеза специфических цитокининов активировали клеточно-опосредованные иммунные реакции, способствуя полноценному развитию плодов. Поэтому и снижался уровень цитотоксических лимфоцитов и естественных киллеров, способствуя функционированию фетоплацентарного комплекса.
Для проверки сделанных выводов сравнили свиноматок контрольной и опытной групп по выходу поросят с одного опороса и уровню мертворожденности в пометах. Данные параметры имеют наибольшее экономическое значение в промышленном свиноводстве, и, как было отмечено, при хронической циркуляции цирковирусной инфекции репродуктивные проблемы сопряжены именно с низкой оплодотворяемостью свиноматок и выживаемостью поросят в пометах. При этом основной причиной мертворожденности у свиноматок является трансплацентарное заражение плодов цирковирусом. Хотя регулярная вакцинация снижает количество репродуктивных потерь, но полностью не устраняет.
У свиноматок контрольной и опытной групп процент мертворожденности поросят в пометах составил, соответственно, 9,67% и 6,43% (рис. 4). Межгрупповые различия были равны 3,24%. Основываясь на том, что синдром мертворожденности в свиноводстве чаще всего связан с инфекциями, в том числе и ЦВС-2, можно утверждать, что сочетание вакцинации против ЦВС-2 с введением «Трансфер Фактора» способствовало повышению эмбриональной выживаемости и жизнеспособности поросят.
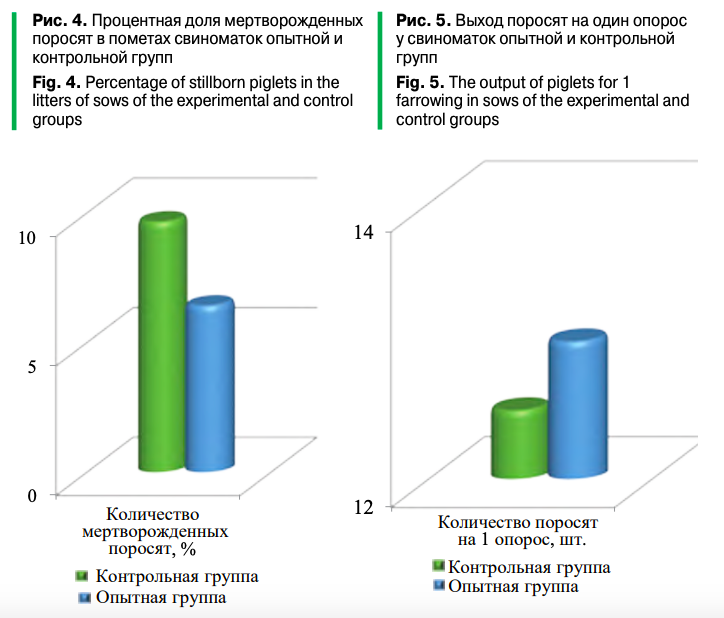
Следующим важным экономическим показателем является размер помета. В условиях экспериментального свинокомплекса для получения товарного поголовья использовались генотипы свиноматок, обладающих потенциально высокой репродуктивной способностью. Поэтому в стандартных технологических условиях, несмотря на наличие мертворожденности, выход поросят на один опорос у свиноматок контрольной группы составил 12,5 голов (рис. 5).
В опытной группе животных при сочетании вакцинации с введением «Трансфер Фактора» снизились «инфекционное давление» и восприимчивость свиноматок к цирковирусу, что позволило повысить выход поросят на один опорос до 13,0 голов. Это дает основание утверждать: изменение «стратегии вакцинации» против ЦВС-2 повлияло на эпидемиологию инфекции, что отразилось на соответствующих экономических показателях.
Выводы
Исследования показали, что вакцинация свиноматок против ЦВС-2 влияет на иммунный статус животных в ходе репродуктивного цикла и количественную выраженность репродуктивных потерь.
Формирование поствакцинального иммунитета, протекающего на фоне осеменения животных, наступления и развития многоплодной беременности в стандартных технологических условиях свинокомплекса, сопровождается: увеличением в крови свиноматок общей концентрации иммуноглобулинов (∑G + M + A) в 1,25–1,59 раза в зависимости от срока супоросности за счет IgG и IgМ; уменьшением абсолютного количества Т- и В-лимфоцитов на 11,84–15,51% и 14,12–17,51% при сохранении их процентной доли в общем пуле лимфоцитов; снижением уровня Т-хелперов на 34,27–36,47% на фоне прироста Т-цитотоксических лимфоцитов, Т-лимфоцитов, экспрессирующих маркеры NK-клеток и истинных натуральных киллеров на 4,47–66,67%, определяя выход поросят на один опорос в количестве 12,5 голов и мертворожденность на уровне 9,67%.
Коррекция иммунного статуса свиноматок путем сочетания вакцинации с введением специфического иммунобиостимулятора направленного действия определяет: прирост концентрации иммуноглобулинов в крови животных в поствакцинальный период на 24,93–71,56% за счет IgG; уменьшение количества Т-лимфоцитов на 19,50–23,76% на фоне увеличения В-лимфоцитов на 20,00–21,25%; сохранение абсолютного числа Т-хелперов в иммунограмме в условиях уменьшения количества Т-цитотоксических лимфоцитов, Т-лимфоцитов, экспрессирующих маркеры NK-клеток и истинных натуральных киллеров в 2,14–3,00 раза, способствуя снижению мертворожденности на 3,24% и повышению выхода поросят на один опорос до 13,0 голов.
Об авторах
Павел Валерьевич Бурков1, кандидат ветеринарных наук, руководитель Научно-исследовательского центра биотехнологии репродукции животных
burcovpavel@mail.ru; https://orcid.org/0000-0001-7515-5670
Марина Аркадьевна Дерхо1, доктор биологических наук, заведующая кафедрой естественно-научных дисциплин
derkho2010@yandex.ru; https://orcid.org/0000-0003-3818-0556
Максим Борисович Ребезов2, 3,
- доктор сельскохозяйственных наук, кандидат ветеринарных наук, профессор, главный научный сотрудник2;
- доктор сельскохозяйственных наук, кандидат ветеринарных наук, профессор кафедры биотехнологии и пищевых продуктов3
rebezov @ya.ru; https://orcid.org/0000-0003-0857-5143
Павел Николаевич Щербаков1 , доктор ветеринарных наук, профессор кафедры инфекционных болезней и ветеринарно-санитарной экспертизы
scherbakov_pavel@mail.ru; https://orcid.org/0000-0001-8685-4645
Арина Олеговна Дерхо1 , студент
arina_avrora@mail.ru; https://orcid.org/0000-0002-1914-8721
Ксения Вадимовна Степанова1 , кандидат биологических наук, доцент кафедры инфекционных болезней и ветеринарно-санитарной экспертизы
deratizator@bk.ru; https://orcid.org/0000–0002–3916–004Х
1Южно-Уральский государственный аграрный университет, ул. им. Ю.А. Гагарина, 13, Троицк, Челябинская обл., 457100, Россия
2Федеральный научный центр пищевых систем им. В.М. Горбатова Российской академии наук, ул. Талалихина, 26, Москва, 109316, Россия
3Уральский государственный аграрный университет, ул. Карла Либкнехта, 42, Екатеринбург, 620075, Россия
УДК 619:616.98:578-08 DOI: 10.32634/0869-8155-2023-377-12-58-66
Сельское хозяйство, ветеринария, зоотехния, агрономия, агроинженерия, пищевые технологии





















