Научно – практические аспекты разработки кормовой добавки

Современный период развития промышленного животноводства характеризуется усилением негативных техногенных факторов, увеличением патофизиологических состояний животных, приводящих к проявлению вторичных иммунодефицитов, снижению генетического потенциала продуктивности. Одним из важнейшим звеном для устранения этих причин является нормированное сбалансированное и полноценное кормление животных.
Организация научно обоснованного кормления и обеспечение животных всеми необходимыми элементами питания усложняются из-за не полного усвоения питательных веществ. Это может быть связанно с нарушением микробиома кишечника, обмена веществ и других факторов окружающей среды, что приводит к снижению продуктивности в целом.
Для совершенствования системы кормления высокопродуктивных животных в условиях промышленного животноводства особое значение отводится функциональным кормовым добавкам, с использованием пробиотических микроорганизмов и пребиотических соединений, повышающих селективные преимущества полезной микрофлоры желудочно-кишечного тракта и её биологическую активность.
Биологически активные добавки, содержащие живые пробиотические микроорганизмы, синтезирующие активные метаболиты в виде аминокислот и других биологически активных соединении, способствуют нормализации микробиома кишечника и коррекции обмена веществ.
Определяющим фактором эффективности метабиотических биологически активных добавок являются технологии их получения. Современный подход к разработке таких добавок предусматривает, во-первых, применение различных видов микроорганизмов нормофлоры кишечника, в определенных сочетаниях, во-вторых, культуральная среда для получения активных метаболитов, которая является основой добавки, должна выпускаться в форме, допускающей длительное хранение при обычной температуре и в-третьих, не терять своих свойств при применении животным.
Значительная часть полезной микрофлоры кишечника животных – бифидобактерии. В. bifidum в организме образуют из органических азотистых соединений некоторые незаменимые аминокислоты — аланин, валин, аспарагиновую кислоту, изолейцин, что имеет важное значение для нормального течения иммунных процессов и синтеза клеточных структур ДНК и РНК. Положительная роль бифидобактерий в организме связана с их способностью дезактивировать токсичные продукты азотного обмена. Бифидобактерии не только стимулируют развитие гуморальной и клеточной защитных систем организма, но и непосредственно подавляют развитие в кишечнике многих видов патогенных бактерий. Установлены их антагонистические свойства по отношению к сальмонеллам, шигеллам, патогенным Е. coli, клебсиеллам, протею, гноеродным коккам, стафилококкам, CI. perfingers, а также холерным вибрионам.
В настоящее, время одним из научных направлений развития средств коррекции метаболизма животных, является применение в кормлении традиционных пробиотиков. Одним из таких препаратов нового поколения представляющей собой натуральный комплекс живых бактерий на основе культивированных штаммов целюлозолитических бактерий рубца жвачных, расщепляющих клетчатку является отечественная кормовая добавка «Целлобактерин», ООО Биотроф (Россия). Широкий диапазон биологического действия данного препарата обусловлен тем, что он объединяет функции двух кормовых добавок: кормового фермента и пробиотика. Целлобактерин представляет собой выделенные из рубца жвачных животных микроорганизмы Clostridium thermocellulociticus, Ruminococcus olbus, Clostridium lochheadii , обладающие целлюлозолитической и молочнокислой активностью. За счет целлюлозолитической активности Целлобактерин, подобно кормовым ферментам, разрушает некрахмальные полисахариды корма. Однако, если в мультиэнзимных композициях каждая ферментная молекула работает в растворе по отдельности, то у бактерий взаимодополняющие ферменты собраны в специализированные блоки на мембранах, что позволяет им разрушать даже плотные структуры клеточных оболочек. Целлобактерин повышает усвояемость не только зерновых, но также подсолнечного шрота и отрубей, для обычных кормовых ферментов малодоступных, за счет молочнокислой активности, также он играет роль классического пробиотика, вытесняет условно-патогенную микрофлору.
Однако, несмотря на довольно широкое использование, пробиотические препараты, содержащие живые клетки, не всегда оказываются высокоэффективными, что связывают, прежде всего, с массовой гибелью бактерий при попадании в желудочно-кишечный тракт. Сохраняют жизнеспособность около 5% вводимых в составе пробиотика клеток.
Новая концепция метабиотиков, важнейшей составляющей которой являются активные метаболиты, пробиотические культуры и их клеточные компоненты, в культуральной среде имеет огромный практический потенциал.
Следует отметить, что вопросам культивирования пробиотических бактерий посвящены многочисленные публикации и изобретения. В предлагаемых модельных исследованиях использованы, как правило, комплексные среды на основании соевого шрота, кукурузного экстракта с применением минеральных компонентов. Анализ литературных данных позволяют предположить, что в качестве исходного сырья для питательной среды перспективной являетсямеласса свекловичная. Эффективные среды для культивирования указанных бактерий могут быть изготовлены с применением питательных основ из достаточно широкого спектра субстратов растительного или иного происхождения. Основу, содержащую необходимые нутриенты, можно использовать в качестве универсального базового компонента при конструировании бактериологических сред различного назначения.
В настоящее время для повышения биологической активности микроорганизмов все чаще используют дешевые питательные среды, на основе которых разрабатывают более совершенные технологии в целях значительного повышения продуктивности бактериальных культур.
Таким образом, разработка питательной среды для культивирования пробиотических организмов, которая является основой биологически активной добавки, является важным этапом проводимых исследований.
Целью исследований является изучение научно практических аспектов культивирования пробиотических микрорганизмов в мелассе свекловичной для разработки кормовой добавки.
Материал и методы исследования
Лабораторные исследования выполнены в лаборатории ветеринарной медицины и биотехнологии Курского Федерального аграрного научного центра в период 2020-2021 гг.
Объектом исследований служили пробиотические микроорганизмы в двух вариантах в виде комплекса микроорганизмов: Clostridium thermocellulociticus, Ruminococcus olbus, Clostridium lochheadii и Bifidobacterium bifidum штамм 1 культивируемые в 5%, 10%, 15%, 20%, 25% мелассе сахарной свеклы. Для посева на питательную среду использовали суточную культуру микроорганизмов, которую стандартизировали до 1х106 КОЕ/см3. Культивирование проводили в течение 14 дней в термостате КВСG 100/250 при температуре 37±1°С. В культуральной жидкости, методом последовательных разведений определяли численность КОЕ/см3. Идентификацию бифидобактерий иClostridium thermocellulociticus, Ruminococcus olbus, Clostridium lochheadiiпроводили микроскопическим методом (окраска мазка по Грамму). Для выделения бифидобактерий использовали Bifidobacterium agar; для выделения не спорообразующих факультативно-анаэробных бактерий использовали среду Эндо.
Массовая доля протеиногенных аминокислот в экспериментальных пробиотических суспензиях (ЭПС) исследовалась методом капиллярного электрофореза по методикам в соответствии с ГОСТ Р 55569-2013, сырого протеина в г/кг по ГОСТ 32044.1-2012. Статистическую обработку показателей проводили с применением методики вариационной статистики для Microsoft Excel. Оценку значимости различий средних арифметических проводили с использованием t-критерия Стьюдента, различия считали статистически значимыми при Р≤0,05.
Результаты и обсуждение
Меласса сахарной свеклы принята нами за основу питательной среды за счет достаточного содержания углеводных компонентов, которые представлены в виде растворимых сахаридов – преимущественно сахарозы, а также в небольшим количеством глюкозы, фруктозы и рафинозы, минеральных веществ (около 10% сырой золы) и небелковых азотных соединений.
При культивировании комплекса пробиотических микроорганизмов максимальное значение 9,5х106 КОЕ/см3 в 20% и 8,5х106 КОЕ/см3 в 15% мелассе достигается на 2–3 сутки, это связано с определенным видом микроорганизма и специфичностью метаболизма за счет легко сбраживаемых углеводов, а повторное нарастание отмечалось на четвертые сутки (1,3–3х106 КОЕ/см3) и достигало максимума на восьмые сутки (9,9х106 КОЕ/см3) при концентрации мелассы 15%.
Проведенные исследования, позволяют отметить вариабельность динамики колониеобразующих единиц (КОЕ 106) пробиотических микроорганизмов по отношению к питательной среде, которой являлась меласса в различной концентрации (рис. 1).
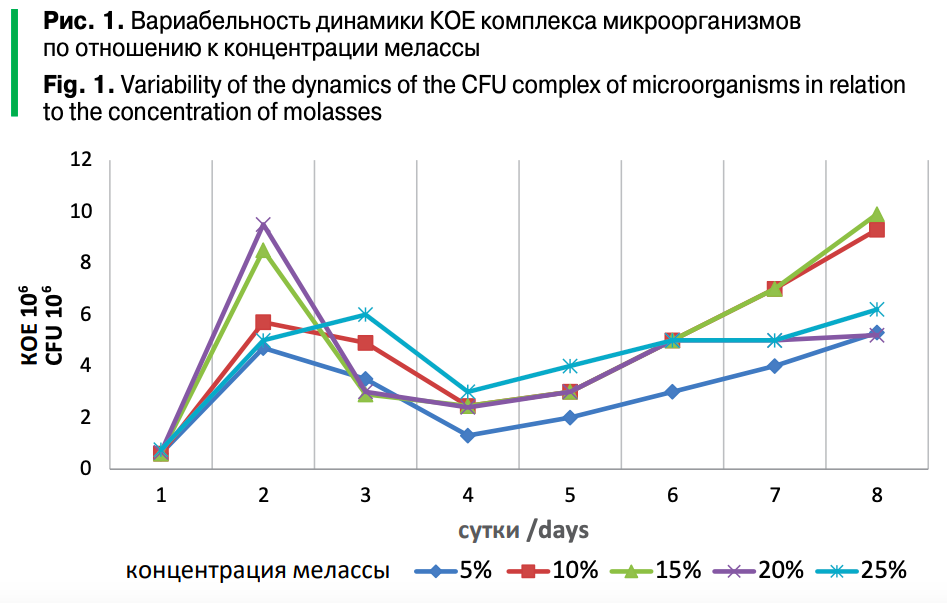
Установлено, что количество пробиотических микроорганизмов, входящих в состав культуральной жидкости на восьмые сутки в 5%-ной питательной среде на основе мелассы, составляет 9,9х106 КОЕ/см3.
Вариабельность динамики колониеобразующих единиц (КОЕ 106) пробиотического микроорганизма B.bifidum по отношению к питательной среде, которой являлась меласса в различной концентрации приведена на рисунке 2.
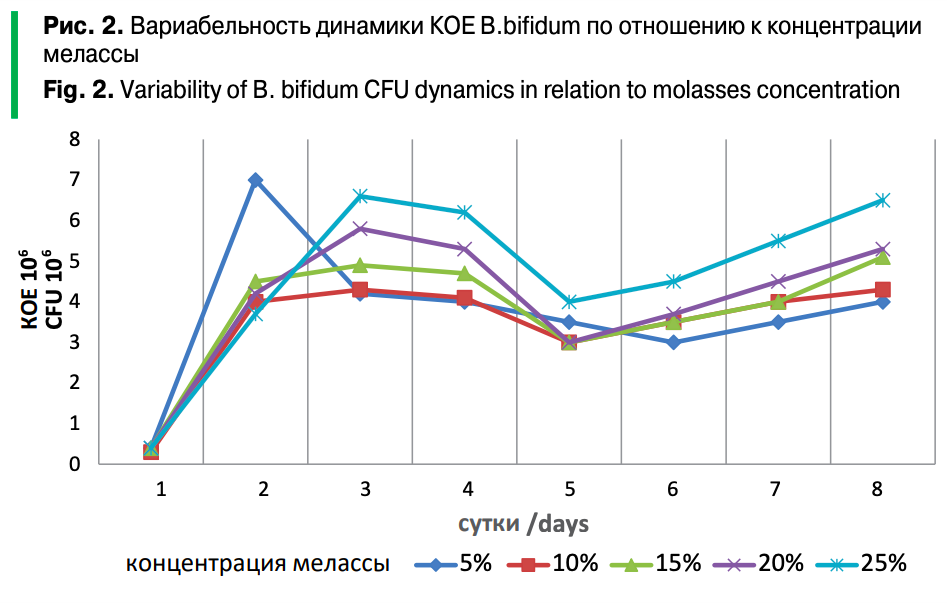
При культивировании на 5% мелассе показатель КОЕ Bifidobacterium bifidum на вторые сутки достигал 7х106 КОЕ/см3. В других концентрациях максимальный показатель количества микроорганизмов приходился на третьи сутки и не превышал 6,6х106 КОЕ/см3. В данном случае низкая концентрация мелассы позволяет бифидобактериям более активно размножаться, расходуя легко сбраживаемые углеводы в течение первых 2-3 суток. На пятые сутки численность снижается до минимальных значений во всех концентрациях мелассы и составляет 3-4х106 КОЕ/см3. С 5-6 суток отмечается повторный рост численности, что возможно связано с переходом бифидобактерий на питание более сложными сахарами, так на восьмые сутки максимальная численность микроорганизмов отмечалась в 25% концентрации мелассы и составила 6,5х106 КОЕ/см3, а минимальная в 5% — 4х106 КОЕ/см3.
Таким образом, максимальный показатель КОЕ Bifidobacterium bifidum в процессе культивирования в мелассе свекловичной достигается при концентрации 5%, а показатель КОЕ Clostridium thermocellulociticus, Ruminococcus olbus, Clostridium lochheadii в 15 % , что служило основанием для дальнейшего исследования.
В культуральной жидкости 15 % мелассы и комплекса микроорганизмов Clostridium thermocellulociticus, Ruminococcus olbus, Clostridium lochheadii по отношению к контролю (15% мелассе), установлено значительное превышение показателей по содержанию лизина и глицина в 3,39, лейцин+изолейцину 1,3 метионина и валина в 2,36, пролина 7,5 раза и других незаменимых и условно заменимым аминокислотам, что свидетельствует о значительной активности комплекса пробиотических микроорганизмов в питательной среде из мелассы (табл. 1).
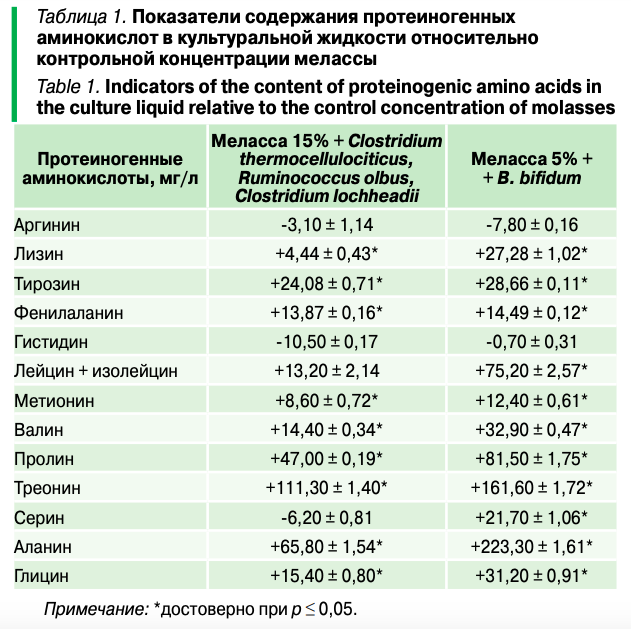
Вместе с тем отмечается тенденция снижения синтеза Аргинина на 5,65%, Серина на 43% и Гистидина на 43%. При этом метаболическая активность B. bifidum в мелассе имеет аналогичную закономерность синтеза отдельных аминокислот. Установлено значительное превышение содержание по Гистидину в 1,13, Серину, Лейцин+Изолейцину, Метионину в 5,5-7 раза и другим не заменимым и условно заменимым аминокислотам, что свидетельствует о значительной активности пробиотических микроорганизмов в питательной среде мелассы. При этом на 42,62% отмечается снижения синтеза Аргинина. Следует предположить, что это связано с пребиотическими свойствами питательной среды из мелассы, в которой содержится необходимое количество аминов, азотосодержащих соединений и аминокислот.
Выводы
1. На основе проведенных исследований определена оптимальная концентрация мелассы свекловичной для получения максимального количество КОЕ культивируемых пробиотических микроорганизмов. При этом 5% меласса является оптимальной для культивирования Bifidobacterium bifidum, а 15% — Clostridium thermocellulociticus, Ruminococcus olbus, Clostridium lochheadii
2. Определена метаболическая активность комплекса микроорганизмов Clostridium thermocellulociticus, Ruminococcus olbus, Clostridium lochheadii, по протеиногенным аминокислотам, установлено увеличение показателей концентрации аминокислот: лизина и глицина в 3,39, лейцин+изолейцин в 1,3, метионина и валина в 2,36, пролина в 7,5 раза по сравнению с контролем.
3. В исследованиях, при культивировании B. bifidum, установлено значительное повышение концентрации гистидина в 1,13, серина, лейцин+изолейцина, метионина в 5,5-7 раза, и других незаменимых и условно заменимых аминокислот, что свидетельствует о значительной активности пробиотических микроорганизма в питательной среде мелассы.
Таким образом, результаты полученных исследований характеризуют культуральную жидкость, как суспензию, содержащую в качестве пребиотика мелассу свекловичную, комплекса пробиотических микроорганизмов и их метаболитов.
Об авторах
Гаяне Агасовна Свазлян, кандидат биологических наук, старший научный сотрудник,
manukyang@yandex.ru; ORCID:0000–0001–9119–1217
Виктор Сергеевич Попов, доктор ветеринарных наук, заведующий лабораторией,
viktor.stugen@yandex.ru; ORCID:0000–0003–3404–1591
Николай Михайлович Наумов, кандидат биологических наук, старший научный сотрудник
naumovnm@rambler.ru; ORCID: 0000–0002–2149–4711
Курский федеральный аграрный научный центр, улица Карла Маркса, 70Б, г. Курск, 305021, Россия
УДК 579.62:612.015.3 DOI: 10.32634/0869-8155-2023-377-12-85-89
Сельское хозяйство, ветеринария, зоотехния, агрономия, агроинженерия, пищевые технологии





















