Экспрессия ключевых генов в слепой кишке у кур линий СМ5 и СМ9 мясного кросса «Смена 9» на фоне замены рыбной муки

В настоящее время производство рыбной муки, которая является основным источником белка в рационах сельскохозяйственной птицы, снижается, а потребность в ней у отрасли птицеводства увеличивается. Зависимость от дорогостоящей рыбной муки — один из рисков для отрасли, поэтому для устойчивого развития птицеводства актуален поиск альтернативных источников белка. Соевый шрот — наиболее подходящая альтернатива для кормления птицы из-за высокого содержания белка, сбалансированности незаменимых аминокислот в составе и более низкой стоимости. Однако присутствие в соевом шроте ряда антипитательных факторов (уреазы, ингибитора трипсина, соевого лектина, фитиновой кислоты, сапонинов, фитоэстрогенов и др.) может приводить к нежелательным эффектам на переваримость, усвоение питательных веществ, вызывать повреждение тканей организма. Помимо этого, в качестве альтернативы рыбной муке представляет интерес шрот подсолнечный, который является побочным продуктом экстракции масла из семян подсолнечника (Helianthus annuus). Он содержит в своем составе меньше антипитательных факторов, кроме танина и фитиновой кислоты, по сравнению с другими шротами из масличных культур. Кроме того, он богат серосодержащими аминокислотами.
Результаты ряда экспериментов продемонстрировали, что птица нового отечественного кросса «Смена 9» может эффективно применяться в мясном птицеводстве. О зоотехнической характеристике отцовской линии корниш СМ5 и материнской линии плимутрок СМ9 кросса «Смена 9» известно, что главные селекционные признаки СМ5 — высокая живая масса, обмускуленность груди и ног при сниженной оплодотворенности яиц и выводе цыплят. СМ9, напротив, имеют превосходство по яйценоскости, массе яиц, выходу цыплят, срокам наступления половой зрелости, жизнеспособности при меньшей скорости прироста живой массы молодняка и более высоких значениях коэффициента конверсии корма.
В ряде опытов на сельскохозяйственной птице показано, что продуктивные параметры животных и птицы могут быть связаны с различными внутриклеточными механизмами, включая экспрессию мРНК. Доказано также влияние состава рациона на экспрессию генов сельскохозяйственной птицы. Известно, что в слепых отростках кишечника птицы экспрессируется множество генов, которые связаны с жизненно важными функциями организма. Благодаря пищеварительной системе происходит взаимодействие организма птицы с окружающей средой, формируется устойчивость к заболеваниям и изменениям условий кормления, что в результате влияет на показатели продуктивности.
В настоящее время отсутствуют исследования по оценке влияния продуктов переработки сои и подсолнечника (в качестве альтернативы рыбной муке) на экспрессию жизненно важных генов у линий СМ5 и СМ9 нового мясного кросса «Смена 9». Поиск связи между ингредиентным составом кормов, генетическим фоном птицы, продуктивностью и уровнем экспрессии ключевых генов может помочь раскрыть новые физиологические механизмы, связанные с высокой продуктивностью, а также способствовать разработке и оптимизации составов рационов.
Цель исследования — в анализе экспрессии генов, связанных с антиоксидантной защитой, иммунитетом, воспалением, апоптозом и продуктивностью в тканях слепых отростков кишечника у родительского поголовья Gallus gallus L. линий СМ5 и СМ9 мясного кросса «Смена 9» на фоне рационов с заменой рыбной муки на продукты переработки сои и подсолнечника.
Материалы и методы
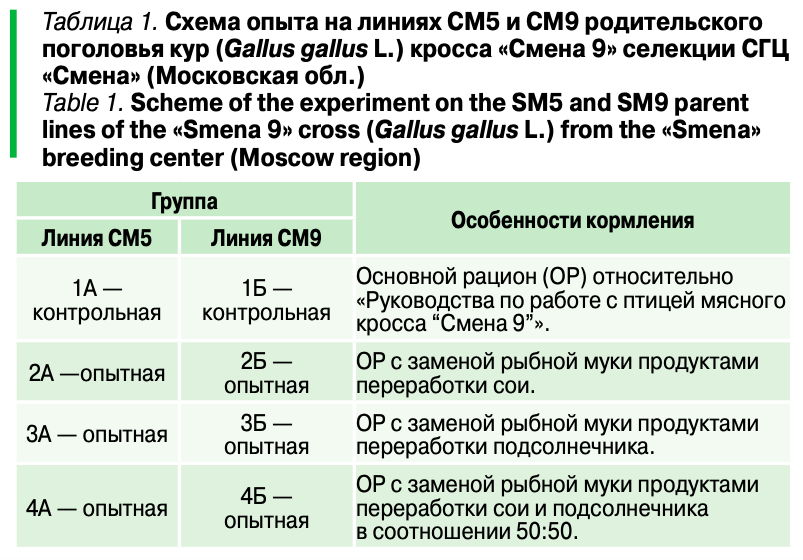
Эксперименты проводили в виварии СГЦ «Загорское ЭПХ» (Московская обл., Россия) в 2022 г. на двух линиях родительского поголовья кур (Gallus gallus L.) отечественного кросса «Смена 9» селекции СГЦ «Смена» (Московская обл.) — отцовской линии СМ5 породы корниш и материнской линии СМ9 породы плимутрок. При постановке эксперимента были соблюдены требования Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях (ETS № 123, Страсбург, 1986).
Условия содержания соответствовали требованиям. В возрасте 26 недель из несушек сформировали восемь групп (по три головы в каждой) с близкой живой массой (табл. 1).
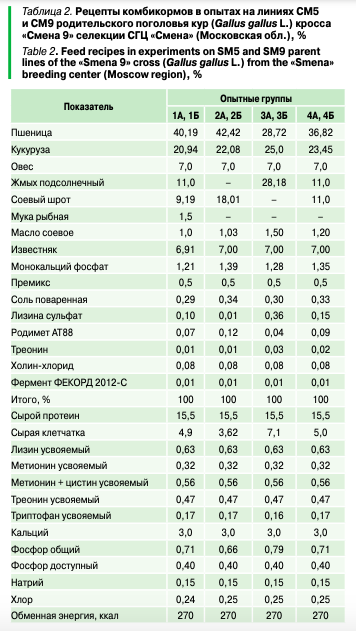
Рецепты комбикормов для птиц различных контрольных и опытных групп представлены в таблице 2.
Мясную и яичную продуктивность птиц кросса «Смена 9» учитывали согласно методикам. Определяли естественную резистентность организма (бактерицидная активность, включая лизоцимную).
В конце эксперимента птицу декапитировали и проводили отбор тканей слепых отростков кишечника для анализа экспрессии генов. Анализ экспрессии генов проводили с помощью количественной ПЦР с обратной транскрипцией. РНК выделяли из образцов тканей с использованием мини-набора Aurum™ Total RNA (Bio-Rad, Hercules, CA, USA), следуя инструкциям производителя. Реакцию обратной транскрипции проводили для получения кДНК на матрице РНК с использованием iScript ™ Reverse Transcription Supermix (Bio-Rad). Для анализа экспрессии мРНК были выбраны специфические праймеры для следующих исследованных генов иммунитета: IRF7, Gal9, Gal10; антиоксидантной защиты: CAT, SOD; продуктивности: SGLT2; воспаления и апоптоза: Casp6, PTGS2. В качестве референсного контроля использовали праймеры на ген «домашнего хозяйства» — белка бета-актина (ACTB). Праймеры, использованные при анализе экспрессии изученных генов, представлены в таблице 3.

Реакции амплификации проводили с использованием SsoAdvanced ™ Universal SYBR® Green Supermix (Bio-Rad, США) в соответствии с протоколом производителя и амплификатором детектирующим ДТлайт (ДНК-Технология, Россия). Режим и условия амплификации были следующими: 5 мин. при 95 °C (предварительный прогрев); 30 сек. при 95 °C, 30 сек. при 60 °C, 30 сек. при 70 °C (40 циклов). Оценка относительного уровня экспрессии проводилась с использованием метода, предложенного Livak и Schmittgen.
Математическую и статистическую обработку результатов осуществляли методом многофакторного дисперсионного анализа (ANOVA) в программах Microsoft Excel XP/2003, R-Studio v. 1.1.453 (https://rstudio.com, США). Достоверность различий устанавливали по t-критерию Стьюдента, различия считали статистически значимыми при р ≤ 0,05. Средние значения сравнивались с использованием теста достоверно значимой разницы Тьюки (HSD) и функции TukeyHSD в пакете R Stats Package (США).
Результаты и обсуждение
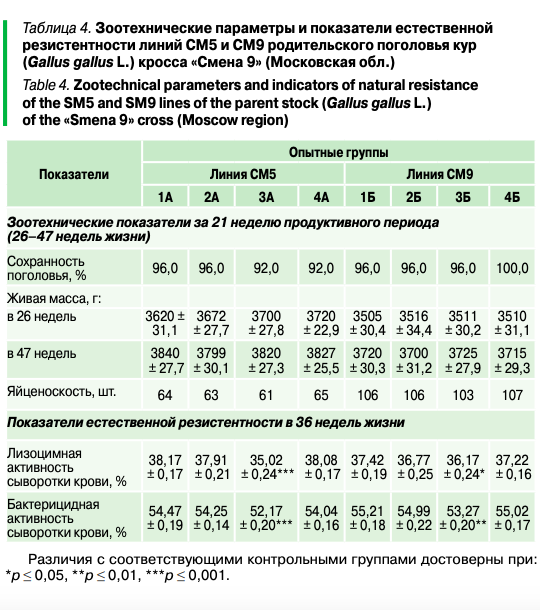
В экспериментах на линиях СМ5 и СМ9 родительского поголовья кур кросса «Смена 9» установлено, что сохранность поголовья за период опыта (26–47 недель) находилась на уровне 96–100% и не имела достоверных различий между группами (р > 0,05) (табл. 4). Кроме того, применение комбикормов растительного типа с разными источниками белка (группы 2А, 3А, 4А, 2Б, 3Б, 4Б) не сказалось отрицательно на показателях яйценоскости и живой массы птицы как по линии СМ5, так и по линии СМ9 (р > 0,05). Так, в 47-недельном возрасте живая масса несушек породы корниш находилась от 3799 ± 30,1 до 3840 ± 27,7 г, а по курам породы плимутрок — от 3700 ± 31,2 до 3725 ± 27,9 г.
При полной замене рыбной муки продуктами переработки подсолнечника (группы 3А и 3Б) показатели лизоцимной и бактерицидной активности сыворотки крови на пике продуктивности мясных кур пород корниш и плимутрок имели достоверное снижение (р ≤ 0,05). Лизоцимная и бактерицидная активность сыворотки крови имеет связь с содержанием врожденных иммунных медиаторов (лизоцима, бактерицидных характеристик крови и т. д.). Данные показатели сыворотки тесно связаны с ответом на инфекцию и широко используются для оценки состояния здоровья. Антимикробные элементы крови обеспечивают быстрые ответы на патогены, поэтому в дальнейшем снижение их выработки в организме может привести к уменьшению устойчивости в ситуациях контакта с возбудителями инфекционных заболеваний.
Результаты анализа методом количественной ПЦР с обратной транскрипцией показали, что в большинстве опытных групп (как в вариантах с линией СМ5, так и с линией СМ9) происходило снижение (р ≤ 0,05) в тканях слепых отростков кишечника по сравнению с контрольными группами 1А и 1Б экспрессии генов SOD и CAT, связанных с антиоксидантной защитой организма птиц (рис. 1). Дело в том, что антиоксидантные ферменты супероксиддисмутаза (SOD) и каталаза (CAT), которые отвечают за радикальную детоксикацию на начальном этапе, создают первый уровень защиты от чужеродных агентов. Производство свободных радикалов, нарушение антиоксидантной защиты и окислительный стресс являются ведущими причинами пагубных последствий стресса у сельскохозяйственной птицы, поэтому снижение экспрессии генов SOD и CAT под влиянием изменения состава рациона в некоторых опытных группах в нашем эксперименте может иметь негативные последствия для организма птиц. Ранее подобных исследований на сельскохозяйственной птице не проводилось. Тем не менее в опытах с аквакультурой показано, что соевый глобулин и β-конглицинин в соевой муке разрушительно действовали на антиоксидантную систему и вызывали окислительное повреждение.
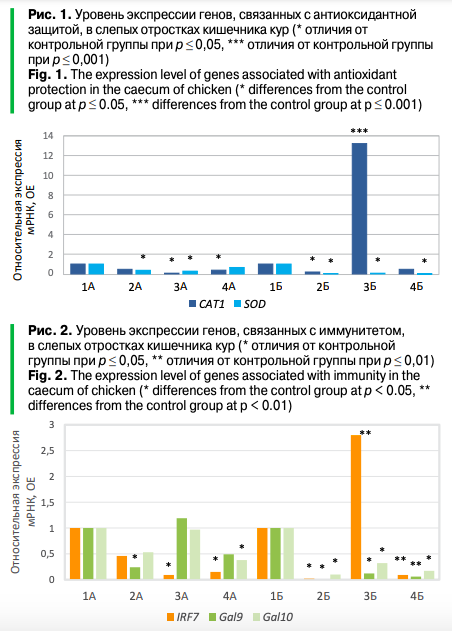
В эксперименте особенно существенные изменения касались гена SOD в опыте на линии СМ9 (р ≤ 0,05), а также гена CAT, экспрессия которого повышалась в 13,2 раза в группе 3Б (р ≤ 0,05). Экспрессия мРНК SOD в группах 2Б, 3Б и 4Б уменьшалась в 14,3–100 раз по сравнению с контролем 1Б (р ≤ 0,05), тогда как на линии СМ5 экспрессия гена SOD в опытных группах 2А и 3А уменьшалась не более чем в 3,5 раза по сравнению с контролем 1А (р ≤ 0,05). Таким образом, эти изменения могли иметь связь с генотипом.
Интересно, что наблюдался также неодинаковый уровень экспрессии генов, связанных с иммунитетом, у птицы разных линий, получавших одинаковый рацион (рис. 2). Так, в опыте на линии СМ9 происходило снижение (до 100 раз) практически во всех опытных группах по сравнению с контролем 1Б экспрессии мРНК генов IRF7, Gal9 и Gal10 (р ≤ 0,05) (исключая экспрессию IRF7 в варианте 3Б). В то же время в опыте на линии СМ5 уменьшение экспрессии генов IRF7, Gal9 и Gal10 было не столь значительно и затрагивало не все варианты опыта (р ≤ 0,05). Снижение экспрессии генов IRF7, Gal9 и Gal10, скорее всего, свидетельствует о происходящих негативных изменениях в организме птицы под влиянием изменений в составе рациона.
Дело в том, что регуляторные факторы интерферона (IRF) представляют собой семейство транскрипционных факторов, которое играет решающую роль в индукции генов, кодирующих интерфероны (IFN), являющиеся критическими факторами в борьбе с вирусными инфекциями. Они составляют первую линию защиты организма от инфекций. IRF7 — это ключевой член семейства IRFS. В свою очередь, Gal9 иGal10 — это дефензины, которые являются факторами, участвующими во врожденном иммунитете. Они обладает антимикробной активностью в отношении различных патогенов, включая грамотрицательные и положительные бактерии, вирусы и грибы. Это позволяет предположить, что замена рыбной муки на продукты переработки подсолнечника и сои может отрицательно сказаться на показателях резистентности у материнской линии СМ9 в случае патогенной нагрузки. Более того, продемонстрировано естественное снижение экспрессии дефензинов в слепых отростках кишечника по мере роста уже с четвертого дня жизни цыплят. Кроме того, Su с соавт. сообщили, что заражение птиц Eimeria acervulina также приводит к падению уровня AvBD1, 6, 10, 11, 12 и 13 в тканях кишечника, что может создавать определенный риск, особенно при разведении поголовья линии СМ9 в условиях промышленного птицеводства.
Полученные данные частично перекликаются с фенотипически наблюдаемым снижением показателей резистентности сыворотки крови в группе 3Б (замена рыбной муки продуктами переработки подсолнечника) в опыте на линии СМ9.
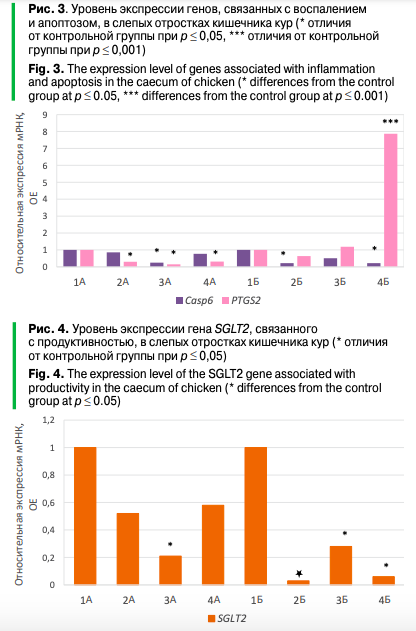
Кроме того, был отмечен разный уровень экспрессии провоспалительного гена PTGS2 у птицы разных линий, получавших одинаковый рацион (рис. 3). Так, в эксперименте на линии СМ5 происходило снижение экспрессии мРНК гена PTGS2 в опытных группах 2А, 3А и 4А по сравнению с контролем 1А от 3,2 до 6,6 раза (р ≤ 0,05). С другой стороны, в эксперименте на линии СМ9 не наблюдалось уменьшения экспрессии данного гена в опытных группах 2Б и 3Б по сравнению с контролем 1Б (р > 0,05), тогда как в опытной группе 4Б даже происходила его индукция в 7,9 раза (р ≤ 0,05). Дело в том, что ген PTGS2 имеет связь с синтезом эндопероксидсинтазы простагландинов (циклооксигеназы 2), которая катализирует окислительное превращение арахидоновой кислоты в простагландин. Простагландин впоследствии метаболизируется до различных биологически активных метаболитов — простациклина и тромбоксана А2, принимая участие как в местных, так и в системных воспалительных реакциях. Ранее в опытах на млекопитающих показано, что гиперэкспрессия PTGS2 может иметь негативные последствия для организма.
Помимо этого, в группе 3А (с заменой рыбной муки продуктами переработки подсолнечника) в опыте на линии СМ5 и в группах 2Б и 4Б (с заменой рыбной муки продуктами переработки сои, а также сои и подсолнечника в соотношении 50:50) в опыте на линии СМ9 наблюдалось снижение мРНК гена Casp6 (р ≤ 0,05) (рис. 4). Каспаза-6 (Casp6) является одной из трех коротких продоменных эффекторных каспаз, участвующих в апоптотической гибели клеток. Супрессия мРНК Casp6 в опытных вариантах, по всей вероятности, не является негативным событием, поскольку ранее сообщалось, что лишь увеличение экспрессии данного гена играет роль в патогенезе различных заболеваний. Ранее в опытах на Carassius auratus gibelio и Cyprinus carpio было, напротив, показано, что при увеличении потребления соевого шрота повышалась экспрессия провоспалительных генов IL-6 и TNF-α.
Изменения в составе рациона оказали также выраженное ингибирующее влияние на уровень экспрессии гена SGLT2 во всех опытных группах по сравнению с контролем 1Б в эксперименте на линии СМ9 (р ≤ 0,05). Так, уровень экспрессии данного гена снижался до 33,3 раза (при замене рыбной муки продуктами переработки сои в группе 2Б) по сравнению с контролем 1Б (р ≤ 0,05). В то же время в опыте на линии СМ5 экспрессия гена SGLT2 снижалась только в варианте 3А в 4,8 раза по сравнению с контролем 1А (р ≤ 0,05). Дело в том, что точная роль SGLT2 для организма птицы неизвестна, однако в опытах на млекопитающих показано, что данный белок — это основной натриевый транспортер глюкозы, которая, как известно, представляет собой источник энергии для птицы. Следовательно, усиление экспрессии мРНК SGLT2 может играть определенную роль в формировании продуктивных качеств. Однако несмотря на то, что замена рыбной муки в рационе птицы в некоторых вариантах опыта приводила к снижению экспрессии гена SGLT2, это всё же не приводило к изменениям продуктивности на уровне фенотипа.
Выводы
Таким образом, замена рыбной муки на продукты переработки (как сои, так и подсолнечника) у родительского поголовья кур линий СМ5 и СМ9 мясного кросса «Смена 9» приводила к изменению экспрессии генов SOD, CAT, IRF7, Gal9, Gal10, PTGS2, Casp6 и SGLT2 в тканях слепых отростков кишечника. Наиболее выраженные изменения в уровнях экспрессии изученных ключевых генов касались линии СМ9 по сравнению с линией СМ5. В вариантах с полной заменой рыбной муки продуктами переработки подсолнечника (группы 3А и 3Б) на уровне фенотипа наблюдалось снижение показателей лизоцимной и бактерицидной активности сыворотки крови. С определенной долей вероятности в случае патогенной нагрузки такие изменения могут привести к негативным последствиям для здоровья птицы из-за снижения общей резистентности. Однако для подтверждения данной гипотезы в дальнейшем необходимы дополнительные эксперименты по искусственному заражению птицы.
Необходимо отметить, что сдвиги в экспрессии ключевых генов птицы не отразились на фенотипе мясной и яичной продуктивности: зоотехнические показатели отмечались на уровне контрольных групп. Вероятно, сдвиги в экспрессии генов были естественной физиологической реакцией на изменение состава рациона.
Полученные результаты обеспечивают теоретическую основу для разработки и оптимизации комбикормов для линий СМ5 и СМ9 нового отечественного мясного кросса «Смена 9».
Об авторах
Елена Александровна Йылдырым1, доктор биологических наук,
deniz@biotrof.ru; https://orcid.org/0000-0002-5846-5105
Лариса Александровна Ильина1, доктор биологических наук,
ilina@biotrof.ru; https://orcid.org/0000-0003-2789-4844
Георгий Юрьевич Лаптев1, доктор биологических наук,
laptev@biotrof.ru; https://orcid.org/0000-0002-8795-6659
Валентина Анатольевна Филиппова1, биотехнолог,
filippova@biotrof.ru; https://orcid.org/0000-0001-8789-9837
Андрей Валерьевич Дубровин1, кандидат ветеринарных наук,
dubrowin.a.v@yandex.ru; https://orcid.org/0000-0001-8424-4114
Дарья Георгиевна Тюрина1, кандидат экономических наук,
tiurina@biotrof.ru; https://orcid.org/0000-0001-9001-2432
Ксения Андреевна Калиткина1, биотехнолог,
ksenya.k.a@biotrof.ru; https://orcid.org/0000-0002-9541-6839
Алиса Сергеевна Дубровина1, биотехнолог,
dasvet@biotrof.ru; https://orcid.org/0009-0005-1879-7497
Екатерина Сергеевна Пономарева1,биотехнолог,
kate@biotrof.ru; https://orcid.org/0000-0002-4336-8273
Владимир Иванович Фисинин2, академик Российской академии наук, доктор сельскохозяйственных наук, профессор, научный руководитель
olga@vnitip.ru; https://orcid.org/0000-0003-0081-6336
Иван Афанасьевич Егоров2, академик Российской академии наук, доктор биологических наук, профессор, руководитель отдела исследований по кормлению птицы
olga@vnitip.ru; https://orcid.org/0000-0001-9122-9553
Татьяна Анатольевна Егорова2, доктор сельскохозяйственных наук, заместитель директора по научно-исследовательской работе,
eta164@yandex.ru; https://orcid.org/0000-0002-5102-2248
Вардгес Агавардович Манукян2, доктор сельскохозяйственных наук, главный научный сотрудник, заведующий отделом питания птицы,
manukyan@vnitip.ru; https://orcid.org/0000-0003-4564-4427
Татьяна Николаевна Ленкова2, доктор сельскохозяйственных наук, профессор, ученый секретарь,
dissоvet@vnitip.ru; https://orcid.org/0000-0001-8391-5000
Ольга Николаевна Дегтярева2 , кандидат сельскохозяйственных наук, научный сотрудник,
fncvnitip@mail.ru; https://orcid.org/0000-0001-7243-7381
1 ООО «БИОТРОФ+», бульвар Загребский, 19, корп. 1, Санкт-Петербург, 192288, Россия
2 Федеральный научный центр «Всероссийский научно-исследовательский и технологический институт птицеводства», ул. Птицеградская, 10, Сергиев Посад, 141311, Россия
УДК 619:616.98:579.852.13 DOI: 10.32634/0869-8155-2023-374-9-52-58
Сельское хозяйство, ветеринария, зоотехния, агрономия, агроинженерия, пищевые технологии





















