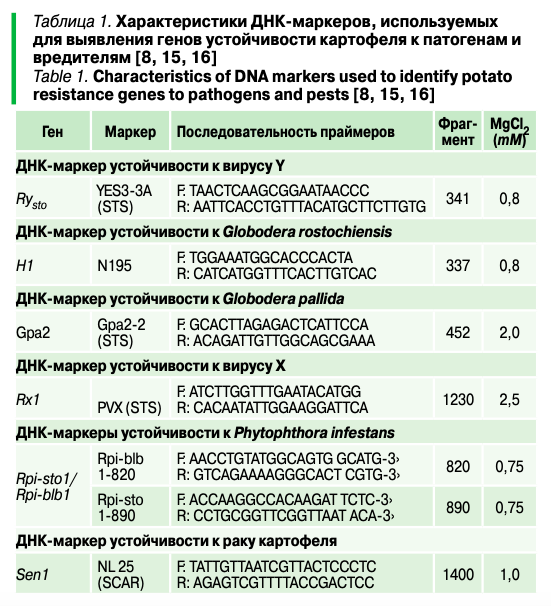
Изучение устойчивости сортов картофеля к Phytophtora infestans (Mont.) de Bary, Synchytrium endobioticum (Schilb.), Globodera pallida (Stone), Globodera rostochiensis (Wollenweber), PVY, PVX в Приморском крае

Возделываемый картофель (Solanum tuberosum) по объемам производства находится на 5-м месте в мире среди всех сельскохозяйственных культур и на лидирующих позициях среди незерновых культур. Россия занимает 3-е место в мире по объемам производства картофеля (после Китая и Индии). Для формирования стратегии селекционных исследований, направленных на создание новых перспективных сортов картофеля, необходимо получение объективной информации о генетическом разнообразии возделываемых селекционных сортов, в том числе о распространении функциональных аллелей генов, контролирующих устойчивость к патогенам и вредителям. В настоящее время ведущие зарубежные генбанки и селекционные центры широко используют методы маркер-опосредованной селекции (Marker Assisted Selection, MAS). При помощи ДНК-маркеров проводят отбор образцов, потенциально устойчивых к цистообразующим нематодам, фитофторозу, к наиболее вредоносным вирусам картофеля. Методы MAS начинают активно применяться в изучении селекционного генофонда картофеля и в России.
Технологии ДНК-маркирования перспективны при создании сортов с длительной устойчивостью к вредным организмам на основе пирамидирования в одном генотипе маркеров разных R-генов, контролирующих устойчивость к разным расам и патотипам вредных организмов и (или) устойчивость к разным патогенам. Ограничением в программах по подбору пар для скрещиваний и пирамидированию генов устойчивости может быть мужская стерильность, широко распространенная среди селекционных сортов картофеля.
Методы ДНК-маркирования имеют большое значение при работе с коллекциями. Наряду с методами MAS для оценки чистоты (идентичности) сортового материала и изучения генетического разнообразия коллекций сортов используются методы молекулярной паспортизации. Поскольку сорта картофеля представлены высокогетерозиготными тетраплоидными генотипами, у межсортовых гибридов отмечается расщепление по изучаемым признакам, в том числе по наличию (отсутствию) ДНК-маркеров определенного локуса. Данные о наследовании ДНК-маркеров доминантных аллелей R-генов устойчивости у межсортовых гибридов служат основой для отбора перспективных гибридных генотипов в потомстве. Кроме того, информация об аллельном составе и степени гетерозиготности маркированных локусов у родительских сортов дает возможность прогнозировать частоту появления в потомстве гибридов, устойчивых к определенному патогену, и планировать объемы анализируемых расщепляющихся популяций.
В зависимости от степени гетерозиготности маркированного R-локуса у исходного сорта частота, с которой в гибридных популяциях появляются устойчивые генотипы, несущие хотя бы один доминантный аллель, будет составлять 100% в случаях квадриплекса (RRRR) или триплекса (RRRr), 83,4% — в варианте дуплекса (RRrr) и 50,0% — для симплекса (Rrrr).
Применение ДНК-маркеров в селекции картофеля имеет наибольшее значение при оценке исходного материала. Однако возможны расхождения в оценках, сделанных за рубежом и в условиях разных агроклиматических зон России. Связано это прежде всего с различным составом популяций патогенов и особенностями экологических условий. Именно поэтому MAS должна сопровождаться фитопатологическим скринингом, особенно в случае оомицетных и грибных патогенов, доступных для исследования, в отличие от карантинных возбудителей.
Цель исследования — изучение сортов на устойчивость к местным изолятам Phytophthora infestans (Mont.) de Bary, а также выявление у сортов генов устойчивости к патогенам и вредителям Phytophtora infestans (Mont.) de Bary, Synchytrium endobioticum (Schilb.), Globodera pallida (Stone), Globodera rostochiensis (Wollenweber), PVY, PVX.
Материалы и методы исследования
Материалом для исследования послужили 23 сорта картофеля: Secura (Германия), Queen Anne (Германия), Red Lady (Германия), Belmonda (Германия), Lilly (Германия), Gala (Германия), Adretta (Германия), Impala (Нидерланды), Latona (Нидерланды), Labella (Нидерланды), Laperla (Нидерланды), Sante (Нидерланды, Россия), Жуковский ранний (Россия), Фиолетовый (Россия), Казачок (Россия), Брянский деликатес (Россия), Смак (Россия), Юбиляр (Россия), Августин (Россия), Памяти Рогачева (Россия), Янтарь (Россия), Гулливер (Россия), Дачный (Россия), востребованные на рынке как семенная продукция и перспективные для селекции образцы в условиях Приморского края.
В качестве стандартов для сравнения были получены из in vitro коллекции ВИР (отдел биотехнологии) образцы диких видов картофеля, демонстрирующие высокую устойчивость к фитофторозу, Solanum bulbocastanum (образец 31741) и Solanum stoloniferum (образец 30519-5) и сорт венгерской селекции Sarpo Mira, имеющий в геноме ген Rpi_Smira1, а также сорт Alouette, предоставленный сотрудниками ВИЗР.
Эксперимент проведен на базе лаборатории селекционно-генетических исследований полевых культур ФГБНУ «ФНЦ агробиотехнологий Дальнего Востока им. А.К. Чайки» с 2019 по 2022 г.
Лабораторная оценка на устойчивость к фитофторозу. Лабораторный скрининг сортов картофеля на устойчивость к фитофторозу проводили по стандартной методике. В качестве инфекционного материала использовали изолят Putzilovka-2019, включающий гены вирулентности. Отделенные листья помещали в плексигласовые поддоны (24 х 33,5 см) на смоченную стерильной водой фильтровальную бумагу абаксиальной стороной вниз: по три листа каждого образца, по три листа восприимчивого сорта Юбиляр и по три листа устойчивого контроля сорта Sarpo Mira, по три листа S. bulbocastanum (образец 31741) и S. stoloniferum (образец 30519-5) в двукратной биологической повторности. Для заражения использовали инокулюм, выдержанный в течение 30 мин. при температуре 10–12 °С для стимуляции выхода зооспор. Инфекционная нагрузка составляла 50 тыс. спорангиев/мл. Инокулюм наносили по одной капле по центру каждого листа между центральной и отходящей жилками. Объем капли составлял 30 мкл. Инокулированные листья выдерживали в течение 24 ч. в темноте при температуре 16 °С.
На протяжении всего эксперимента поддоны были закрыты полиэтиленовой пленкой для поддержания постоянной влажности. Через сутки после инокуляции листья переворачивали абаксиальной стороной вверх, после чего кюветы переносили в климатический бокс с температурой 16 °С, интенсивностью освещения 1600 лк и 16-часовым фотопериодом.
Учет результатов заражения проводили на 6-е сутки после инокуляции по стандартной шкале с подразделением образцов на группы устойчивости:
| Балл | Пораженная площадь, % |
| 9 | 0 |
| 8 | 3,0 |
| 7 | 3,1–10,0 |
| 6 | 10,1–25,0 |
| 5 | 25,1–75,0 |
| 4 | 75,1–90,0 |
| 3 | 90,1–97,0 |
| 2 | 97,1–99,0 |
| 1 | 100 |
Растения с типом реакции, соответствующим баллам 7,0–9,0, относили к классу устойчивых (R), 4,0–6,0 — среднеустойчивых (RS), 1,0–4,0 — восприимчивых (S). Статистическую обработку проводили в программе Past 3.17.
Молекулярный скрининг образцов. ДНК выделяли из зеленых листьев растений картофеля (суммарная проба пяти растений), выращенных в условиях культуральной комнаты с использованием процессора магнитных частиц KingFisher Duo Prime (Thermo Scientific, Сингапур) и набора реактивов MagMAX Plant DNA Kit (Thermo Fisher Scientific, Литва).
Выбор молекулярных маркеров для выявления генов устойчивости картофеля, а также праймеры к ним проводили по литературным источникам. Были выбраны маркеры PVX гена Rx1, Gpa2-2 гена Gpa2, N195 гена Н1, Yes3A гена Rysto, Rpi-blb 1-820 и Rpi-sto 1-890 гена Rpi-sto1/Rpi-blb1, а также NL 25 гена Sen1 (табл. 1). Оптимизацию ПЦР проводили подбором оптимального соотношения компонентов реакционной смеси и температурного профиля программы амплификации с использованием позитивных контролей — ДНК сортов картофеля, имеющие в своем геноме искомые гены согласно литературным источникам, Метеор (Rysto, Rx1, Sen1, Gpa2, H1), Вектор (Rx1, Gpa2), Юбиляр (Gpa2), Жуковский ранний (Gpa2, Rx1), а также образцы высокоустойчивых к фитофторозу клонов диких видов S. bulbocastanum (образец 31741 с генами Rpi-blb1 и Rpi-blb3) и S. stoloniferum (образец 30519-5 с генами Rysto и Ryfsto), предоставленные отделом биотехнологии ВИР с информацией о наличии ДНК-маркеров генов. ПЦР проводили в 10 мкл 2Х реакционной смеси БиоМастер HS-Taq ПЦР-Color (без содержания Mg2+) («Биолабмикс», Россия) с добавлением хлорида магния до оптимальной концентрации для каждого маркера индивидуально (табл. 1) в термоциклере Т100 (Bio-Rad, США). В реакцию использовали 10–50 нг ДНК-матрицы. Был применен температурный протокол мультиплексной реакции, которые ставили индивидуально.
Для выявления маркеров гена устойчивости к фитофторозу (табл. 1) был разработан оригинальный температурный протокол амплификации, позволяющий на одной программе выявлять оба молекулярных маркера: 95° — 5 мин.; 10 циклов 95° — 30 сек., 65°(-0,5°/цикл) — 30 сек., 72° — 1 мин.; 35 циклов 95° — 30 сек., 60° — 30 сек., 72° — 1 мин.; постэлонгация 72° — 5 мин. В качестве исходного протокола амплификации использовали параметры, описанные в оригинальной статье. Продукты ПЦР разделяли электрофорезом в 2%-ном агарозном геле, окрашенном бромистым этидием. Визуализацию фрагментов ДНК проводили УФ-облучением с помощью гельдокументирующей системы Gel-Doc GO (Bio-Rad, США). Для определения длины фрагментов использовали маркеры длин фрагментов Step 50 plus, Step 100 и Step 100 Long («Биолабмикс», Россия).
Наличие или отсутствие искомого маркера определяли сравнением с позитивным контролем, имеющим фрагмент определенной длины.
Результаты и обсуждение

Лабораторный эксперимент. По данным лабораторного эксперимента, шесть сортов из коллекции ФГБНУ «ФНЦ агробиотехнологий Дальнего Востока им. А.К. Чайки» оказались устойчивыми к местным изолятам возбудителя фитофтороза картофеля Latona, Брянский деликатес, Gala, Дачный, Казачок, Adretta (9 баллов, R). Остальные показали разный уровень устойчивости или восприимчивости. Из них можно отметить сорта Laperla, Belmonda, Impala, Фиолетовый, Жуковский ранний, Queen Anne, Sante, Янтарь, которые выделялись достаточно высоким уровнем устойчивости (от 7,0 до 8,6 балла, R) (рис.1).
Проверка значимости нулевой гипотезы (p = 0,181), а также оптимальной линейной несмещенной оценки дисперсии к ее обычной оценке методом максимального правдоподобия (W = 0,7756) указывает на высокую достоверность полученных результатов и валидность применяемых методик (табл. 2).
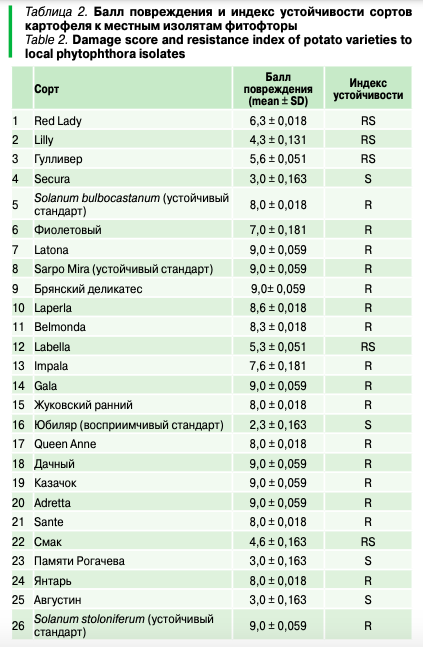
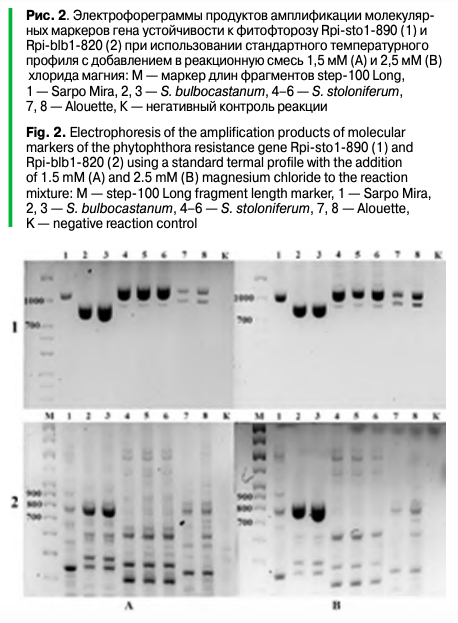
Оптимизация ПЦР для выявления маркеров гена устойчивости к фитофторозу Rpi-sto1/Rpi-bib1.Большинство используемых молекулярно-генетических маркеров были отработаны нами ранее, однако выявление гена устойчивости к фитофторозу Rpi-sto1/Rpi-bib1 в исследовании был использован впервые. Поэтому до проведения исследования целевых образцов потребовалась отработка ПЦР для выявления маркеров этого гена (Rpi-sto1-890, Rpi-bib1-820). В результате использования состава реакционной смеси и температурных профилей реакции из литературных источников был получен неоднозначный ответ вследствие наличия неспецифических продуктов реакции, затрудняющих их интерпретацию (рис. 2, 3).
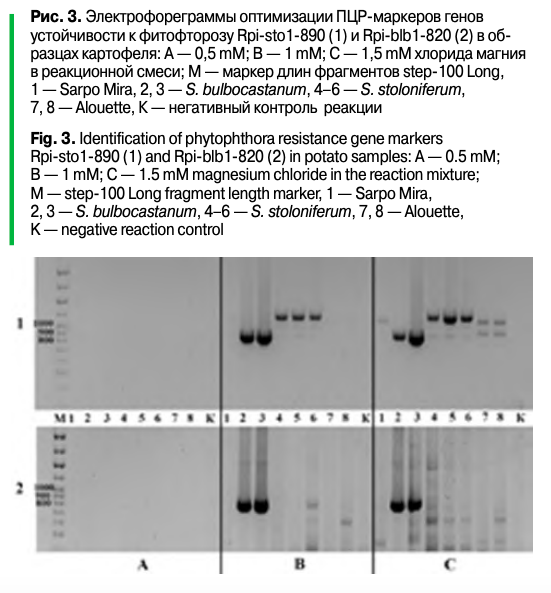
Для оптимизации ПЦР в реакционную смесь добавляли разное количество хлорида магния. Наилучшие результаты получены на следующем температурном профиле: 95° — 5 мин.; 10 циклов 95° — 30 сек., 65°(-0,5°/цикл) — 30 сек., 72° — 1 мин.; 35 циклов 95° — 30 сек., 60° — 30 сек., 72° — 1 мин.; постэлонгация 72° — 5 мин. Данный протокол оказался эффективен для выявления обоих маркеров — Rpi-sto1-890 и Rpi-blb1-820. Для оценки эффективности данных маркеров у сортов культурного картофеля была использована ДНК сорта Сударыня, имеющего данный ген устойчивости к фитофторозу (по литературным данным) (рис. 4).
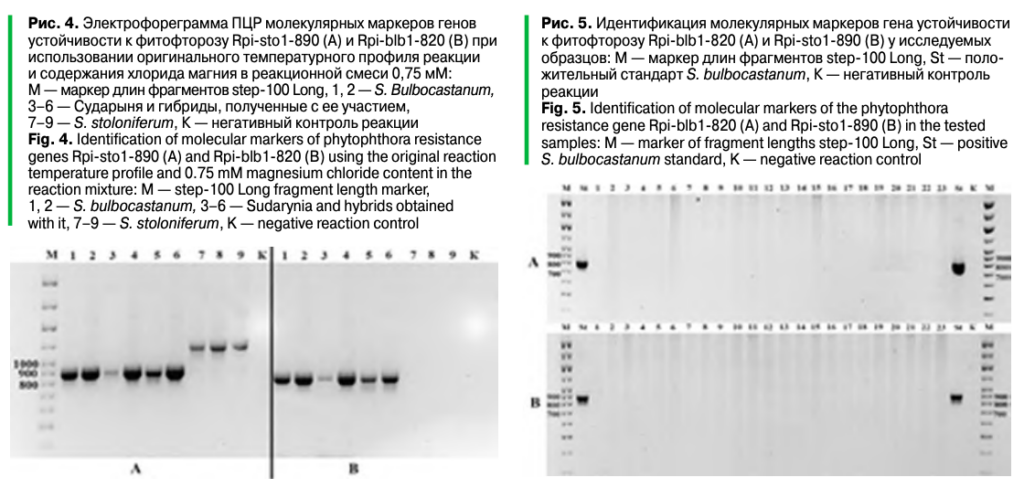
Стоит отметить выявленную особенность молекулярного маркера Rpi-sto1-890, а именно наличие фрагмента большей длины (порядка 1100 п. н.) у образца Solanum stoloniferum, даже при оптимальных условиях и близких к оптимальным условиям протекания реакции. Ситуация усугубляется при постановке реакции в условиях, способствующих протеканию неспецифических реакций. В процессе оптимизации ПЦР обнаружено, что у образцов Solanum stoloniferum иAlouette амплифицируются два фрагмента (один из которых совпадает по размеру с маркерным, но значительно бледнее, второй более яркий — порядка 1100 п. н.), а у Sarpo Mira — один (~1100 п. н.) (рис. 2–4).
Полученные данные указывают на возможные сложности интерпретации результатов в случае отсутствия позитивных стандартов и (или) плохого разрешения продуктов при электрофорезе (малая длина пробега, низкие концентрации агарозы, неполное разрешение маркера длин фрагментов). Так, в статье Е.П. Шаниной с соавторами указано наличие маркера Rpi-sto1-890 для ряда образцов, в том числе и Sarpo Mira, при отсутствии Rpi-bib1-820, на основании чего делается вывод о наличии у данных образцов искомого гена. Однако лишь один образец в исследовании (СМ 503-55) имеет оба маркера, а значит, может действительно иметь искомый ген, в то время как для остальных образцов получен ложноположительный результат в силу описанных выше особенностей используемых молекулярных маркеров. Вероятно, как минимум часть образцов, имеющих в генотипе элементы генома Solanum stoloniferum, могут выявлять данный неспецифический фрагмент порядка 1100 п. н. либо оба фрагмента, что может приводить к ложноположительным результатам при работе с данным молекулярным маркером.
Скрининг сортов картофеля. Важным направлением селекции является создание сортов, устойчивых к комплексу заболеваний, таких как фитофтороз, вирусные и грибные инфекции, а также паразитические нематоды. Применение ДНК-маркеров для идентификации ценных генотипов ускоряет процесс отбора устойчивых сортов, тем самым повышая эффективность селекции.
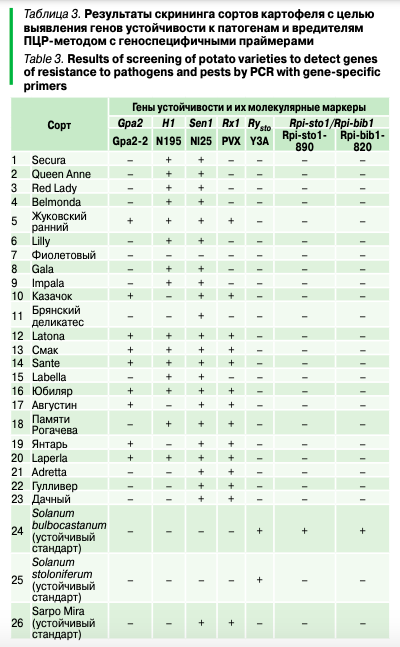
В работе был проведен молекулярный скрининг 23 сортов картофеля, а выявление генотипов — с маркерами генов: H1 и Gpa2, контролирующих устойчивость к золотистой цистообразующей и бледной нематодам; ген Senl, обеспечивающий устойчивость к раку картофеля; ген Rx1 —устойчивость к X-вирусу, ген Rysto — к вирусу Y, а также ген Rpi-sto1/Rpi-bib1, обеспечивающий устойчивость к широкому спектру рас возбудителя фитофтороза (табл. 3).
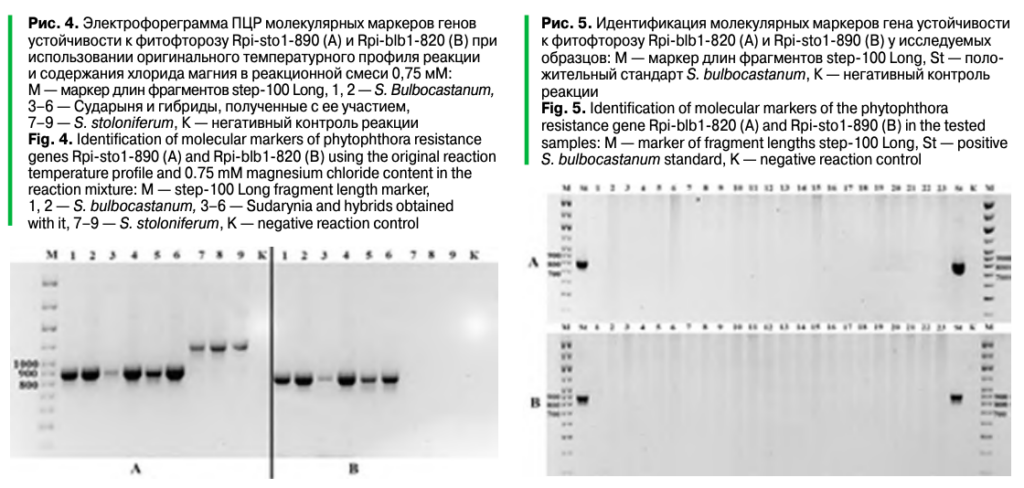
Наибольшую частоту встречаемости имел маркер гена устойчивости к раку картофеля (Senl) Nl25, выявленный у 22 сортов (97%). Этот факт обусловлен тем, что устойчивость к S. endobioticum является обязательным требованием для включения новых сортов в реестр селекционных достижений. Известно, что из идентифицированных в настоящее время генов, контролирующих устойчивость к бледной и золотистой цистообразующей нематодам, наиболее эффективную защиту обеспечивают H1 и Gpa2. Ген устойчивости H1 был выявлен у 15 сортов, что составляет 65% от общей выборки, а Gpa2 — у 9 сортов (40%). 6 образцов имеют доминантные аллели обоих генов. Ген Rxl, кодирующий устойчивость к вирусу Х, обнаружен у 13 сортообразцов. В результате исследований выделен ряд сортов картофеля с комплексной устойчивостью к патогенам и вредителям: Смак, Sante, Юбиляр, Жуковский ранний, Laperla (Rx1, H1, Gpa2, Sen1); Памяти Рогачева, Августин, Казачок, Янтарь (Rx1, Gpa2, Sen1); Gala, Impala, Lilly, Adretta, Дачный (Rx1, Sen1). Маркеры устойчивости Y3A и Rpi-sto1-890 присутствовали только у устойчивого стандарта Solanum bulbocastanum (рис. 5).
Использование сортовой устойчивости к болезням в картофелеводстве всегда было очень актуальным. Так, для Московской области описаны сорта картофеля Гала, Тимо-Ханкиян и Гермес, которые в условиях тенденции к потеплению климата демонстрировали высокий уровень урожайности, а также устойчивости к фитофторозу и альтернариозу, что частично согласуется с исследованиями.
В условиях орошения степной зоны Южного Урала наибольшей устойчивостью к поражению фитофторозом обладают сорта картофеля Артемис, Эроу и Спиридон. Слабое поражение растений и клубней (до 2,2%) отмечалось у сортов Романо, Тарасов, Кузовок. Сорта Памяти Коваленко, Невский и Родрига отличаются слабой расоспецифической и полевой устойчивостью к фитофторозу.
Выводы
Большинство изученных сортов продемонстрировали устойчивость к местным изолятам фитофторы на уровне иммунных стандартов. Восприимчивыми оказались только Secura и Августин, средневосприимчивыми — Red Lady, Lilly, Гулливер, Labella и Памяти Рогачева. На данном этапе исследования не удалось связать устойчивость к фитофторозу с используемыми молекулярными маркерами гена Rpi-sto1/Rpi-bib1 вследствие его отсутствия в представленной выборке. Аналогичная ситуация и с маркером гена Rysto, поскольку они довольно слабо представлены в популяции культурного картофеля и чаще всего имеются у единичных образцов.
Таким образом, наблюдаемая устойчивость, вероятно, обеспечена другими генами. В результате молекулярно-генетического скрининга исследуемых образцов выявлен ряд сортов картофеля, имеющих комплекс маркеров генов устойчивости к патогенам и вредителям: Смак, Sante, Юбиляр, Жуковский ранний, Laperla (Rx1, H1, Gpa2, Sen1); Памяти Рогачева, Августин, Казачок, Янтарь (Rx1, Gpa2, Sen1); Gala, Impala, Lilly, Adretta, Дачный (Rx1, Sen1).
Об авторах
Петр Викторович Фисенко, кандидат биологических наук, ведущий научный сотрудник,
phisenko@bk.ru; https://orcid.org/0000-0003-1727-4641
Наталия Валериевна Мацишина, кандидат биологических наук, старший научный сотрудник,
mnathalie134@gmail.com; https://orcid.org/0000-0002-0165-1716
Юлия Сергеевна Попова, младший научный сотрудник,
alexbronskaya@gmail.com
Дмитрий Игоревич Волков,младший научный сотрудник,
volkov_dima@inbox.ru; https://orcid.org/0000-0002-9364-9225
Тамара Ивановна Хоружева, младший научный сотрудник,
tamaraserbakova736@gmail.com; https://orcid.org/0000-0002-0140-394x
Марина Владимировна Ермак, младший научный сотрудник,
ermackmarine@yandex.ru; https://orcid.org/0000-0002-37278634
Ольга Абдулалиевна Собко, научный сотрудник,
o.eyvazova@gmail.com; https://orcid.org/0000-0002-4383-3390
Федеральный научный центр агробиотехнологий Дальнего Востока им. А.К. Чайки, ул. Воложенина, 30Б, пос. Тимирязевский, Уссурийск, Приморский край, 692539, Россия
УДК 632.4.01/.08:632.938.1:571.27 DOI: 10.32634/0869-8155-2023-374-9-126-132
Сельское хозяйство, ветеринария, зоотехния, агрономия, агроинженерия, пищевые технологии





















