Иммунохроматографическая тест-система для экспресс-диагностики бешенства

Бешенство (лат. rabies) входит в группу трансмиссивных вирусных зооантропонозов, глобально влияющих на здравоохранение и общественную экономику. Несмотря на низкие показатели заболеваемости людей гидрофобией в Российской Федерации (до 10 человек в год), в среднем около 400 тыс. подвергаются нападению подозрительных по заболеванию животных, что свидетельствует о сохранении напряженной эпизоотолого-эпидемиологической ситуации на территории ряда регионов страны.
Согласно ГОСТ 26075-2013, для диагностики бешенства приоритетны МФА на культуре клеток, ИФА, реакция диффузной преципитации (РДП), полимеразная цепная реакция с обратной транскрипцией (ОТ-ПЦР). «Золотым стандартом» является биологическая проба на белых мышах с последующей индикацией вирусного антигена в МФА, однако метод, несмотря на свою достоверность и чувствительность, требует использования животных и характеризуется длительными сроками получения результата. Наблюдается тенденция к отказу от исследований с применением животных делает актуальными дальнейшую разработку и совершенствование диагностических методов in vitro. Одним из перспективных экспресс-методов является иммунохроматографический анализ (ИХА), обладающий рядом преимуществ: низкой стоимостью, простотой проведения анализа, стабильностью при транспортировке без холодовой цепи, что делает его идеальным вариантом для первичной диагностики персоналом, не имеющим специальной квалификации. В ряде стран Азии и Африки, эндемичных по бешенству, тест-системы на основе ИХА широко используются для первичного мониторинга бешенства.
ИХА основан на движении элюента вдоль мембраны (метод бокового потока), которая сопровождается образованием на разных ее участках специфических иммунокомплексов, детектируемых в виде окрашенных полос. Для формирования визуального сигнала в тестах используются ферментные, латексные и металлические метки, наиболее распространенными среди которых являются наночастицы коллоидного золота (НчКЗ). Метки на основе коллоидного золота в настоящее время широко применяются для индикации антигенов возбудителей бактериальных, вирусных, паразитарных и грибковых заболеваний, токсинов, растительных антигенов, а также для дот-блот гибридизации.
Цель исследования — конструирование иммунохроматографической тест-системы для экспресс-диагностики бешенства.
Материалы и методы исследования
Исследования проведены в лаборатории вирусных антропозоонозов ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности» («ФЦТРБ-ВНИВИ», Казань, Россия) в 2022–2023 гг.
Выделение гликопротеина вируса бешенства. Вирус бешенства (штамм «Овечий» ВГНКИ, коллекция ФГБНУ «ФЦТРБ-ВНИВИ») с инфекционным титром (6,23 ± 0,1) lg LD50/0,03 мл культивировали на клетках почки сирийского хомячка (ВНК-21/13) при множественности инфицирования (MOI) 0,01. Через 72 ч. культивирования клеточные монослои подвергали трехкратному криолизу, клеточный дебрис осаждали при 4000 g в течение 30 мин., после чего осветленный супернатант ультрацентрифугировали при 30 000 g в течение 4 ч. на центрифуге Optima XE-100 (Beckman Coulter, США). Вторичный супернатант подвергали очистке методом гель-фильтрации с поэтапным контролем очистки вируса посредством аналитического disc-электрофореза и вестерн-блоттинга.
Получение антирабических глобулинов. За основу выделения γ-глобулиновой фракции из пула сывороток овец, иммунизированных рабическим гликопротеином, был взят классический метод переосаждения раствором сульфата аммония (5,9 М, рН 5,4) из расчета 50% конечного насыщения. Процедуру переосаждения глобулинов проводили трижды, при каждом цикле исходный объем растворяемого осадка после центрифугирования при 5000 g уменьшали на 25%. Осадок промывали в растворе 2,78 М сульфата аммония, после чего проводили исчерпывающий диализ против 0,025 М трис-HCl буфера (pH 7,8). Конечные глобулиновые фракции подвергались концентрированию в закрытых диализных мешках при отрицательном давлении (-500 мБар) и хроматографической очистке на ДЭАЭ-целлюлозе со скоростью элюции 0,7 мл/мин. Специфичность полученных глобулинов определяли методом стрипового вестерн-блота с использованием контрольного антигена вируса бешенства.
Синтез наночастиц коллоидного золота. Наночастицы коллоидного золота (НчКЗ) с диаметром 25–30 нм получали из золотохлористоводородной кислоты (ЗХВК) модифицированным методом цитратного синтеза по Френсу, при этом объемы 1%-ного раствора ЗХВК и 1%-ного раствора цитрата натрия составляли 0,58 мл и 0,72 мл соответственно (на 50 мл золя). После синтеза золь охлаждали до комнатной температуры и доводили рН до 9,0 при помощи 0,2 М К2CO3. Гомогенность золя и размерность НчКЗ контролировали микроскопически.
Просвечивающая электронная микроскопия. Образцы золя золота наносили на медные сетки с подложкой из пиолоформа и высушивали. Съемку НчКЗ осуществляли в просвечивающем электронном микроскопе JEM-100CX (JEOL Ltd., Япония) на увеличении 50 000 при ускоряющем напряжении 80 кВ. Измерения НчКЗ проводили в программе ImageJ/FIJI.
Измеряли все частицы, индивидуально обнаруживаемые в зрительном поле, при условии, что граница частицы просматривается по всему периметру и не формирует слитный силуэт с соседней частицей. Дополнительно рассчитывали коэффициент округлости частиц по формуле:
С = 4П х (S/P)2 ,
где C — коэффициент округлости, S — площадь, P — периметр.
Конъюгация наночастиц коллоидного золота с глобулинами. Предварительную характеристику связывания НчКЗ с антителами определяли по стабилизации конъюгатов в солевом растворе согласно Сотникову и соавт. Стабилизирующую концентрацию определяли как концентрацию белка в точке выхода на плато флоккуляционной кривой с превышением значения концентрации на 10%. Далее к 10 мл золя золота (рН 9,0–9,5) добавляли по каплям раствор белка с выбранной концентрацией и инкубировали в течение 30 мин. при комнатной температуре с периодическим перемешиванием. По завершении конъюгации к смеси для блокирования несвязавшихся сайтов НчКЗ и стабилизации препарата добавляли 0,25 мл 4%-ного раствора ПЭГ-20000 и БСА до конечной концентрации 0,25%. Для отделения несвязавшихся антител конъюгат осаждали в течение 30 мин. при 8000 g при +4 ºС. Осадок ресуспендировали в 1 мл ФБР и хранили при +4 ºС с добавлением NaN3. Для оценки эффективности иммобилизации глобулинов на НчКЗ 200 мкл калибровочных растворов белка добавляли к 200 мкл НчКЗ и инкубировали 1 час при комнатной температуре, после чего центрифугировали при 12 000 g. Количество свободных IgG в надосадке оценивали методом количественного нИФА.
Сборка мультимембранного композита и постановка иммунохроматографического анализа. Для проведения ИХА в прямом (сэндвичном) варианте был собран мультимембранный композит из мембран MDI Easypack (MDI, Индия) в следующем порядке: на аналитической мембране CNPF-SN12-L2-P25 со скоростью потока 2 см/мин, закрепленной на пластиковой подложке, формировали тестовую (антирабические глобулины барана) и контрольную (аффинно-очищенные антивидовые антитела кролика против барана (ООО «Имтек», Россия) зоны. К нижнему краю подложки крепили мембрану для образца GFB-R4 и стекловолоконную подложку PT-R5, пропитанную нанозолотым конъюгатом и высушенную в течение 20 ч. при комнатной температуре, к верхнему краю — адсорбирующую мембрану AP080. Собранные композиты размещали в пластиковых микрокассетах, после чего осуществляли постановку ИХА путем нанесения в соответствующую зону анализируемого образца в объеме 100 мкл. Результаты регистрировали визуально в течение 3 мин.
Валидация результатов. О специфичности ИХА судили по количеству совпадений отрицательных результатов (в процентном отношении) тестирования 20 образцов стандартной диагностической панели с результатами их исследования в непрямом ИФА и РИФ. Для оценки специфичности в исследуемую панель были включены 10 образцов, в которых вирусный антиген не был выявлен ни одним из вышеперечисленных методов, а также 10 образцов, полученных из головного мозга мышей, экспериментально зараженных эпизоотическим штаммом вируса болезни Ауески «Арский» (инфекционный титр 3,0 ± 0,2 lg LD50 / 0,03 мл).
Статистический анализ. Обработку первичных данных и статистические тесты проводили с использованием пакетов программ MS Excel и Statistica 6.0 (StatSoft, США).
Результаты и обсуждение
Характеристики синтезированных наночастиц коллоидного золота. Имеются сведения, что основными недостатками большинства методов, основанных на химическом восстановлении ЗХВК, являются широкий диапазон размерностей частиц и ограниченная стабильность золей, однако метод Френса позволяет получить относительно монодисперсные НчКЗ диаметром 10–60 нм. Выбор определенного расчетного диаметра НчКЗ был сделан исходя из того, что он существенно влияет на эффективность мечения. Так, наиболее распространенными в биотехнологическом применении являются НчКЗ диаметром 20–40 нм.
На первом этапе исследований была синтезирована и морфометрически охарактеризована экспериментальная партия золей золота, параметры НчКЗ в которых указаны в таблице 1 и на рисунке 1.
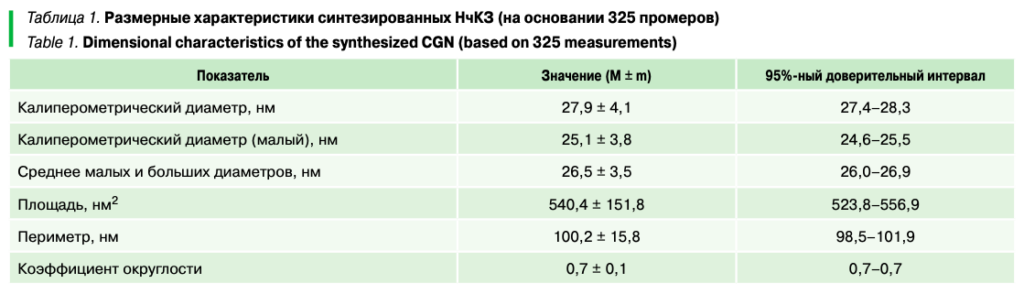
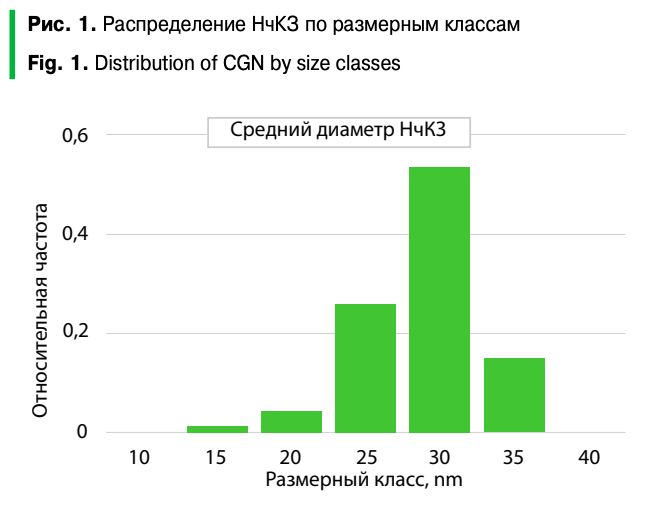
Из таблицы 1 видно, что цитратный синтез по протоколу получения НчКЗ с прогнозируемым диаметром 25–30 нм позволяет получить НчКЗ с фактическим диаметром 26,5 ± 3,5 (95% CI 26,0–26,9), а основное количество частиц попадает в размерный класс 25–30 нм (рис. 1), что позволяет определить их как кондиционные и пригодные для дальнейшей конъюгации с антителами. Согласно данным электронной микроскопии, полученные частицы относительно однородны по размеру и форме и не образуют конгломератов, что свидетельствует об их стабильности (рис. 2).
Получение конъюгатов наночастиц коллоидного золота с антирабическими антителами.Конъюгирование НчКЗ с белками — сложный многофакторный процесс; протоколы получения подобных конъюгатов основываются преимущественно на эмпирических представлениях, противоречиво характеризующих процесс иммобилизации. Известно, что оптимальный состав конъюгата антител с НчКЗ, обладающего максимальной аффинностью взаимодействия в иммунохимических реакциях, зависит от индивидуальных особенностей иммобилизуемого глобулинового препарата. Так, на втором этапе исследований была осуществлена иммобилизация антирабических антител на поверхности НчКЗ методом прямой (нековалентной) сорбции. Применяемый лабораторный образец антирабического иммуноглобулина имел активность (предельный титр) в непрямом ИФА — 1:20480, в реакции нейтрализации флуоресцирующими антителами (модификация FAVN) — (8,2 ± 0,7) МЕ/мл, а также не проявлял кросс-реактивности с гетерологичными антигенами. Количественные характеристики процесса иммобилизации представлены в таблице 2.
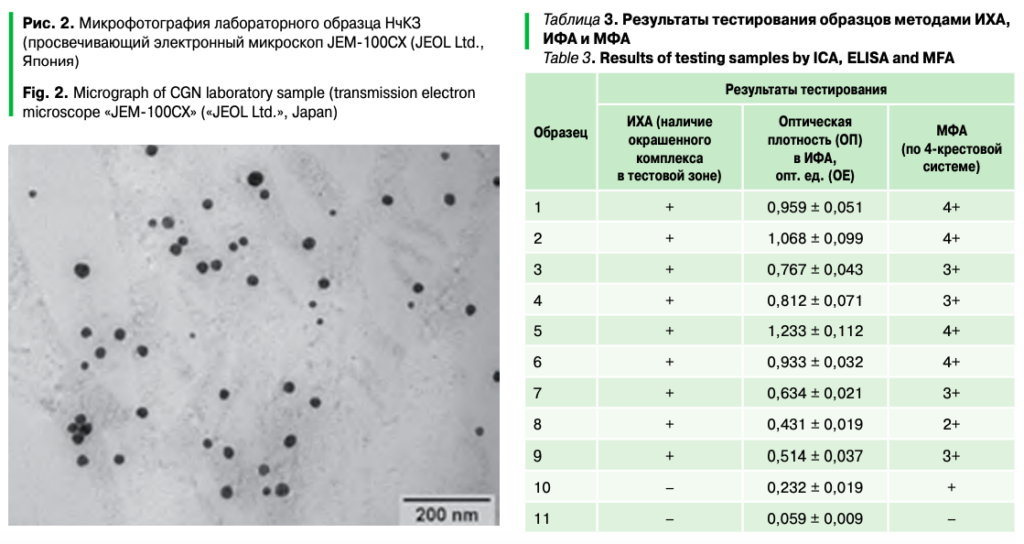
Постановка иммунохроматографического анализа.Проведение ИХ-серодиагностики может быть реализовано в нескольких вариантах, которые отличаются порядком образования иммунокомплексов на мембранах, а следовательно, и составом НчКЗ-меченого комплекса. В исследовании применялась классическая схема прямого (сэндвичного) ИХА, при котором жидкая фаза (образец, содержащий искомый антиген) связывается с мечеными специфическими антителами и в процессе миграции по твердой фазе образует в тестовой зоне окрашенный комплекс с нанесенными специфическими антителами («сэндвич» НчКЗ-антитело — антиген — антитело). Результаты сравнительного тестирования образцов стандартной диагностической панели методами ИХА, ИФА и МФА представлены в таблице 3.
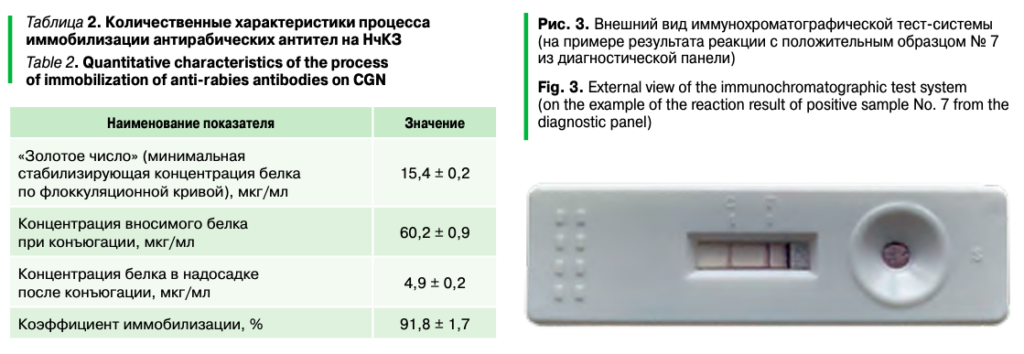
Из таблицы 3 видно, что при исследовании 9 из 10 заведомо положительных (в ИФА и МФА) образцов методом ИХА результаты демонстрировали высокую корреляцию (во всех случаях в тестовых зонах мембран наблюдалось формирование иммунокомплекса в виде дискретных полос разной степени насыщенности). Наиболее яркие (сопоставимые с окрашиванием контрольной зоны) тестовые полосы формировались при исследовании явно положительных образцов, для которых характерна ОП в ИФА в диапазоне 0,412–1,345 ОЕ, а также флуоресценция специфических комплексов в МФА, оцениваемая не менее чем в три креста (3+). Внешний вид иммунохроматографической тест-системы (на примере результата реакции с положительным образцом № 7 из диагностической панели) представлен на рисунке 3.
Образец № 10 с ОП (0,232 ± 0,019) ОЕ, соответствующей «зоне сомнительных результатов» для используемой ИФА-тест-системы, в ИХА не реагировал, что объясняется меньшим содержанием антигена, а также заведомо более высоким порогом чувствительности ИХА-теста относительно аналогичных реакций в жидкой фазе. При тестировании подборки отрицательных образцов, а также гетерологичных антигенов сопоставимость результатов составила 100%, что свидетельствует об отсутствии ложноположительных реакций и кросс-реактивности.
Выводы
В результате исследований был сконструирован прототип иммунохроматографической тест-системы для экспресс-диагностики бешенства животных. Ее первичные испытания подтвердили функциональность предлагаемого подхода для экспресс-индикации антигена вируса бешенства в образцах патологического материала: при исследовании образцов диагностической панели ИХА продемонстрировал прямую корреляцию с результатами ИФА и МФА, отсутствие ложноположительных реакций и кросс-реактивности. Однако образцы, характеризующиеся меньшим содержанием антигена и оптической плотностью, соответствующей зоне «сомнительных результатов» в ИФА, демонстрировали отрицательный результат в ИХА. Исходя из этого, в контексте дальнейших исследований актуальна задача снижения порога чувствительности тест-системы, которая может быть решена усилением контраста между тестовой и контрольной зонами путем взаимодействия иммунозолотого маркера с атомами серебра (silver enhancement), а также применением инструментальной регистрации результатов.
Об авторах
Антонина Глебовна Галеева; кандидат ветеринарных наук, старший научный сотрудник,
antonina-95@yandex.ru; https://orcid.org/0000-0003-2650-6459
Шамиль Минесалихович Насыров; кандидат ветеринарных наук, ведущий научный сотрудник,
shamyl777@mail.ru; https://orcid.org/0000-0001-9483-8383
Глеб Сергеевич Кашеваров; кандидат биологических наук, старший научный сотрудник,
kaschewarow@mail.ru; https://orcid.org/0000-0002-4520-7596
Марина Анатольевна Ефимова; доктор биологических наук, ведущий научный сотрудник:
marina-2004r@mail.ru; https://orcid.org/0000-0002-0908-4058
Замиля Загитовна Алеева; младший научный сотрудник,
https://orcid.org/0000-0001-6205-9460
Гузалия Салиджановна Арутюнян; младший научный сотрудник,
https://orcid.org/0000-0002-9146-6855
Гельфиря Минзагитовна Яруллина; младший научный сотрудник,
https://orcid.org/0000-0002-0413-5936
Рафаил Мазитович Ахмадеев;
кандидат ветеринарных наук, ведущий научный сотрудник,
ahm_rafail@mail.ru; https://orcid.org/0000-0002-1732-6977
Вадим Владимирович Сальников; доктор биологических наук, профессор, заведующий кабинетом электронной микроскопии, Федеральный центр токсикологической, радиационной и биологической безопасности, Научный городок-2, Казань, 420075, Россия; Казанская государственная академия ветеринарной медицины имени Н.Э. Баумана, ул. Сибирский тракт, д. 35, Казань, 420029, Россия; Казанский институт биохимии и биофизики – обособленное подразделение ФИЦ «Казанский научный центр Российской академии наук», ул. Лобачевского, 2, Казань, 420111, Россия
salnikov_russ@yahoo.com; http://orcid.org/0000-0002-2367-672X
УДК 616.98:578.824.11 DOI: 10.32634/0869-8155-2023-374-9-32-37
Сельское хозяйство, ветеринария, зоотехния, агрономия, агроинженерия, пищевые технологии





















