Цирковирус как фактор, контролирующий эффективность беременности у свиноматок

Основным возбудителем цирковирусных заболеваний свиней, распространенных во всем мире, является цирковирус 2-го типа (ЦВС-2). Он преимущественно повреждает клетки лимфоидных тканей, приводя к «истощению» их функций и развитию иммуносупрессии в организме животных. В то же время механизмы, с помощью которых ЦВС-2 запускает развитие заболевания, до конца не выявлены, что и актуализирует исследования в данном направлении.
В промышленном свиноводстве важным фактором, влияющим на эффективность отрасли, является сбалансированность репродуктивного цикла свиноматок при сохранении уровня их плодовитости. Установлено, что в формировании репродуктивной функции свиноматок значительную роль играют не только экологические и физиологические факторы (рацион, возраст, срок беременности, технология содержания), но и инфекционные агенты. Репродуктивные проблемы у свиноматок выявлены при циркуляции в их организме таких вирусов, как вирус репродуктивно-респираторного синдрома свиней, парвовируса свиней, цирковируса свиней, вируса болезни Ауески, вируса гриппа A, вируса энцефаломиокардита и энтеровируса свиней.
В последние годы появились исследования, в которых свиной цирковирус предложен в роли одного из основных патогенов, связанных причинно-следственной связью с репродуктивными заболеваниями свинок и свиноматок, ранними эмбриональными потерями, абортами на последних сроках беременности, мертворождением, преждевременными опоросами, мумифицированием плода, нерегулярным возвратом к эструсу. Вакцинация свинок и свиноматок против ЦВС-2 не привела к улучшению репродуктивной функции, оцениваемой по скорости опороса и размеру приплода. Полевые исследования и лабораторные тесты показали, что репродуктивные потери от ЦВС-2 у свиноматок сопряжены с видом коинфекции, которая потенцирует влияние ЦВС-2 на органы размножения.
По данным, основной причиной «репродуктивных потерь» в условиях субклинической цирковирусной инфекции является снижение эффективности иммунологических процессов в организме животных как результат развития лимфопении и нейтрофилии.
В организме позитивных к ЦВС-2 свинок вирус обнаруживается в тканях яичников и матки и непосредственно в клетках эндометрия, лимфоцитах и макрофагах матки, в ооцитах и гранулезных клетках яичников. Частота выявления ЦВС-2 в тканях матки и яичников связана с количеством абортов, патологических выделений из влагалища и аноэструса. Выяснение причин неонотальной смертности поросят или их рождения с врожденным тремором и атаксией задних конечностей показало, что у мумифицированных или мертворожденных плодов антиген ЦВС-2 оказывает «высокую нагрузку» на миокард, печень и селезенку, что позволяет придать ему этиологическое значение.
По данным, ЦВС-2 обладает тропизмом к клеткам сердца плода, инициируя дегенерацию миокарда, некроз, фиброз и негнойный миокардит. При этом по мере развития беременности тропизм вируса к миокардиоцитам плода снижается, но повышается по отношению к лимфоидным тканям. Кроме этого, ЦВС-2 способен проникать через плаценту и вызывать внутриутробную инфекцию у свиноматок.
В тканях вирусно абортированных и гипотрофированных поросят могут и не выявляться выраженные макроскопические поражения внутренних органов. В то же время у инфицированных свиноматок могут рождаться «нормальные» поросята. Однако у серопозитивных к ЦВС-2 свиноматок выживаемость эмбрионов более низкая, чем у серонегативных, так как ооциты, инфицированные ЦВС-2, увеличивают риск получения инфицированных ЦВС-2 эмбрионов в условиях экспрессии антигена ЦВС-2 во всех типах фолликулов яичников и желтых тел.
Цель исследования — микроскопическое исследование внутренних органов вирусно абортированных плодов с целью выяснения причин репродуктивных потерь в условиях субклинически протекающей цирковирусной инфекции у свиноматок.
Материалы и методы исследования
Исследовательская часть работы выполнена на товарном свинокомплексе ООО «Агрофирма “Ариант”» в 2022–2023 гг. (Челябинская обл., Россия). В период исследований поголовье свиноматок в репродуктивном цехе составляло 199–220 голов, возраст которых колебался от года до трех лет. Порода свиноматок была либо дюрок х ландрас, либо дюрок х йоркшир. Продуктивное долголетие животных — 2,7 опороса на свиноматку. Технология содержания и кормления организована по рекомендациям Genesis (Канада). Движение свиноматок в репродуктивном цехе, количество задаваемого корма на одну голову и его питательная ценность были сопряжены с физиологическим состоянием животных. Холостых свиноматок, а также беременных в первую треть супоросности содержали групповым методом, в последнюю треть супоросности, в период опороса и подсоса — в индивидуальных боксах. В сектор опороса свиноматок переводили за неделю до предполагаемой даты родов. Подача корма и питьевой воды автоматизирована. Для кормления используется жидкий корм, раздача которого осуществляется двукратно. На предприятии имеется свой кормоцех, в производстве комбикорма используются корма собственного производства или закупаемые у региональных поставщиков.
Для профилактики цирковирусной виремии на предприятии используется вакцинация и применяется вакцина «Ингельвак ЦиркоФЛЕКС» (Германия). Она вводится свиноматкам в рекомендуемых производителем дозах при отъеме поросят, то есть на 21-е сутки после родов. В ходе эксперимента состояние свиноматок после вакцинации визуально контролировали на наличие побочных реакций в течение двух часов.
Ветеринарные специалисты репродуктивного цеха всех свиноматок постоянно осматривают на наличие клинических признаков заболевания, связанного с ЦВС-2, включая потерю веса, диарею и одышку, лихорадку. В репродуктивном цехе ежедневно фиксируется общее количество абортов, рожденных и мертворожденных поросят, количество отъемышей на одну свиноматку.
Гистологическое исследование внутренних органов аборт-плодов. Для проведения гистологических исследований были использованы кусочки печени, плаценты, пуповины, селезенки и головного мозга, полученные от аборт-плодов свиноматок в последний триместр супоросности, имеющих клинические признаки заболеваний, связанных с инфекцией ЦВС-2. Размер кусочков органов — 1 см3. Их фиксировали 10%-ным раствором формалина на протяжении 24 часов, промывали проточной водой 1 час и заливали в парафин по следующей схеме: последовательное обезвоживание в 70%-ном, 80%-ном и 96%-ном спирте (по четыре часа в каждом), пересушивание в смеси спирта и хлороформа (1:1) — один час, хлороформ — два часа, нагревание в смеси хлороформа и парафина — один час при температуре 37 °С, пропитывание двумя порциями парафина — по 45 минут при 56 °С, изготовление блоков.
Гистологические срезы толщиной 5 мкм изготавливали на санном микротоме МС-2. Перед окраской срезы депарафинировали в ксилоле в течение двух минут, затем ксилол удаляли 96%-ным этиловым спиртом в течение двух минут и промывали дистиллированной водой. Для проведения окрашивания на срез наносили каплю гематоксилина на две-три минуты, промывали водой пять-десять минут, наносили каплю эозина на одну минуту, вновь промывали водой, обезвоживали в двух порциях 96%-ного спирта по одной минуте в каждой, проводили окончательное обезвоживание в 100%-ном спирте в течение одной минуты, две минуты просветляли в ксилоле, заключали окрашенный препарат в бальзам и покрывали покровным стеклом.
Для обнаружения липидов в печени фиксированные формалином ткани окрашивали суданом III без заливки в парафин. Для этого замороженные срезы помещали в спиртовой раствор красителя на 15–20 минут, ополаскивали в 50%-ном спирте, промывали дистиллированной водой и заключали в глицерин для микроскопии. Срезы микроскопировали при различном увеличении, фотографировали с помощью микроскопа Leica DMRXA (Leica Microsystems, Германия) и камеры Leica DFC 290 (Leica Microsystems, Германия).
Статистическую обработку данных проводили с помощью табличного процессора Microsoft Excеl–2003 (США) и пакета прикладной программы «Биометрия».
Дизайн экспериментальных исследований рассмотрен и одобрен Комитетом по биоэтике Южно-Уральского государственного аграрного университета (Челябинская обл., Россия).
Результаты и обсуждение
Клиническая оценка. Побочных реакций на вакцину «Ингельвак ЦиркоФЛЕКС» (Германия) у свиноматок после вакцинации в период исследований не наблюдалось, однако в репродуктивном цехе в ходе клинико-диагностического обследования периодически выявлялись особи с клиническими признаками заболеваний (лихорадка, вялость, диарея, одышка, выделения из влагалища и аборт), связанных с инфекцией ЦВС-2. При этом более 50% абортов наблюдалось у свиноматок с типичными клиническими признаками цирковирусной инфекции свиней.
Макроскопическое исследование аборт-плодов. При вскрытии аборт-плодов грубых поражений внутренних органов не наблюдалось, однако у некоторых аборт-плодов были выявлены легкая многоочаговая дегенерация и некроз миокарда, лимфоидное истощение в селезенке.
Микроскопическое исследование аборт-плодов. Ценным индикатором «вирусного аборта» являются микроскопические исследования тканей внутренних органов абортированных плодов свиноматок в последнюю треть супоросности. Для микроскопических исследований были использованы метаболически и иммунологически важные органы, определяющие, с одной стороны, возможность внутриутробного развития поросят, а с другой — являющиеся «мишенями» для тропизма вируса ЦВС-2.
1) Жизненно важной железой не только в организме животных, но и развивающегося плода является печень. В эмбриональный период она подвергается разнообразным морфологическим изменениям, позволяющим органу выполнять биологические функции — как в плодный период, так и после рождения. Состояние печени у плода принято соотносить с его развитием, так как в пренатальный период онтогенеза не только формируется собственно печеночная ткань, но ткани печени также являются и органом кроветворения.
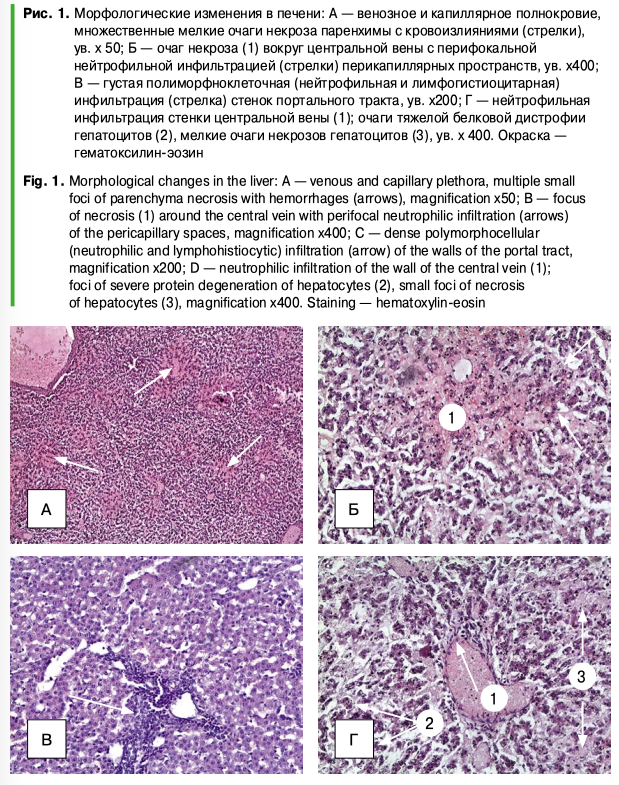
При исследовании микроскопических препаратов печени аборт-плодов свиноматок было выявлено следующее. Во всех полях зрения — паретическое венозное и капиллярное полнокровие с картиной эритростазов и отделением плазмы от форменных элементов. Балочное строение отчетливо выражено. Перикапиллярные пространства Диссе резко расширены, печеночные балки дискомплексованы. В некоторых препаратах видны множественные мелкие и средние очаги некрозов гепатоцитов с кровоизлияниями в некротизированную ткань (рис. 1А). Кровоизлияния представлены массами компактно лежащих гемолизированных эритроцитов с группировками клеток белой крови на их фоне и выпадением свободно лежащих глыбок и зерен гемосидерина (рис. 1Б). Очаги некрозов локализуются в различных отделах долек, но не выходят за их пределы. В перифокальных зонах — умеренная нейтрофильная инфильтрация перикапиллярных пространств.
Стенки портальных трактов резко отечны, разволокнены, с густой полиморфно-клеточной инфильтрацией по их ходу (рис. 4В). Стенки центральных вен набухшие, с умеренной нейтрофильно-лимфоцитарной инфильтрацией (рис. 1Г). Сохранившиеся гепатоциты — в состоянии тяжелой белковой гидропической и баллонной дистрофии (вплоть до некробиоза) (рис. 1Б, 1В, 1Г).
2. Селезенка хотя и не является жизненно важным органом, но обладает рядом специфических свойств в организме свиней. В ранний период внутриутробного развития основной функцией селезенки является кроветворение. По мере формирования ее структуры она превращается в орган иммунной защиты и в организме взрослых животных входит в состав периферической лимфатической системы, контролируя состав лимфоидных клеток, состояние клеточного, гуморального, врожденного и приобретенного иммунитета. Согласно данным, развитие селезенки в организме свиней сопряжено с уровнем экспрессии генов, определяющих иммунные и противовоспалительные реакции.
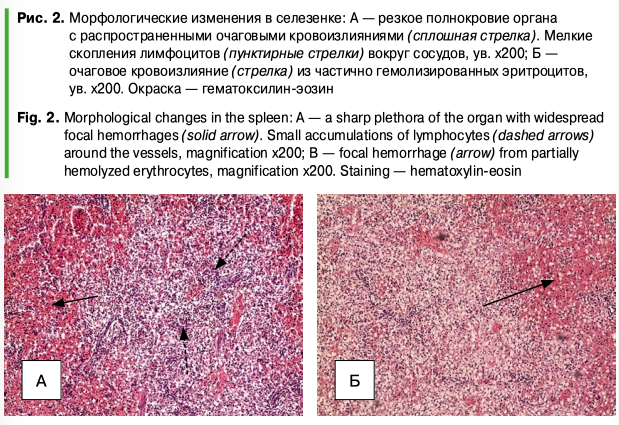
При микроскопическом исследовании препаратов селезенки аборт-плодов было выявлено, что капсула органа хорошо выражена. Трабекулы тонкие, короткие, представлены в небольших количествах. Разделение на красную и белую пульпу неотчетливое. Небольшие скопления лимфоцитов определяются вокруг сосудов и трабекул (рис. 2А). Во всех препаратах выявляется резчайшее полнокровие пульпы с картиной распространенных кровоизлияний, состоящих из частично гемолизированных эритроцитов и небольших скоплений клеток белой крови (рис. 2А, 2Б).
3. Головной мозг. Вопросы внутриутробного развития головного мозга свиньи до сих пор являются малоизученными. В настоящее время известно, что мозг плода свиньи быстро растет в течение последних 50 дней перед рождением. Важную роль в этих процессах играет метилирование ДНК дифференциально экспрессируемых генов, которое может модифицироваться под воздействием факторов окружающей среды. В исследованиях установлено, что паттерны аберрантного метилирования ДНК в клетках нервной ткани модифицируются при различных заболеваниях.
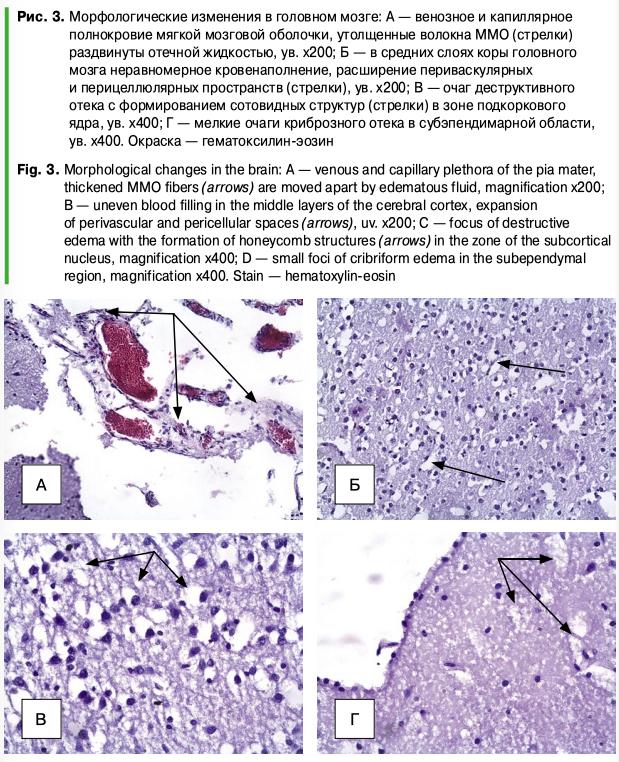
При исследовании гистологических препаратов головного мозга аборт-плодов свиноматок с клиническими признаками ЦВС-2 было выявлено венозное и капиллярное полнокровие мягкой мозговой оболочки с картиной сладжирования эритроцитов. Волокна оболочки утолщены, разрыхлены, раздвинуты отечной жидкостью (рис. 3А). В коре головного мозга, в белом веществе и области подкорковых ядер — неравномерное кровенаполнение: на фоне полнокровия капилляров и вен мелкого калибра встречаются участки дистонии и спазма сосудов микроциркуляторного русла (рис. 3Б, 3В). Расширение периваскулярных и перицеллюлярных пространств (рис. 3Б, 3В), разрежение молекулярного слоя коры, очаги сотовидного разрежения вещества мозга в области подкорковых ядер (рис. 3В). В стенке бокового желудочка эпендимарная выстилка сохранена, в субэпендимарной области видны мелкие очаги криброзного отека вещества мозга (рис. 3Г).
4. Важную роль в период внутриутробного развития играет пуповина, посредством которой развивающийся плод соединен с организмом матери и имеет возможность дистанционного магистрального обмена кровью, то есть пуповина является частью фетоплацентарного круга кровообращения, обеспечивающего потребности плода в ходе беременности. При этом патология развития пуповины является одной из основных причин перинатальной смертности за счет гипоксии плода, асфиксии новорожденных и мертворожденности.
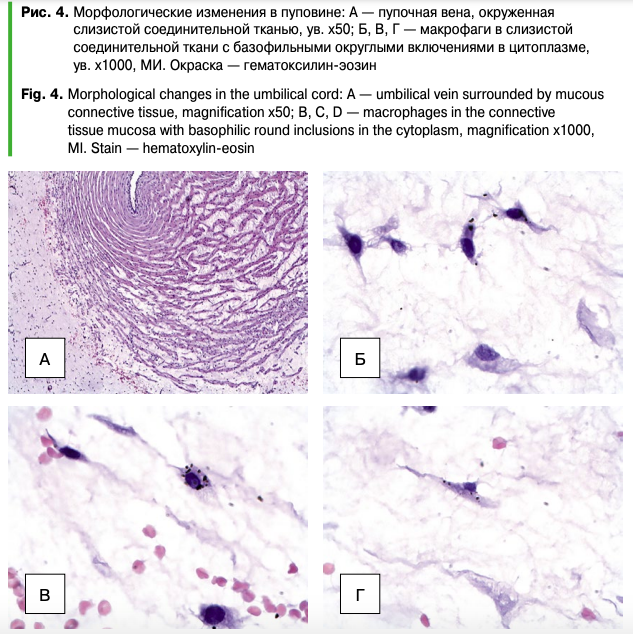
При микроскопическом исследовании препаратов, полученных из пуповины аборт-плодов свиноматок с клиническими признаками цирковирусной инфекции, было отмечено, что она представлена двумя артериями, по которым кровь плода доставляется в микроциркуляторное русло плаценты, и веной, обеспечивающей отток оксигенированной крови плаценты в сосудистое русло плода. Артерии и вены пуповины в поперечном срезе окружены слизистой соединительной тканью с небольшими включениями рудиментов желточного мешка и аллантоиса (рис. 4А). В слизистой соединительной ткани видны макрофаги с базофильными округлыми включениями в цитоплазме (рис. 4Б, 4В, 4Г).
5. В период внутриутробного развития особая роль принадлежит плаценте, которая обеспечивает доставку питательных веществ (например, аминокислот и воды) и кислорода от матери к плоду, а также удаление метаболитов плода (например, аммиака и CO2) от плода к матери, поэтому рост и развитие плаценты — определяющие факторы выживания, роста и развития плода. Плацента также может являться и путем передачи инфекции от матери к плоду, вызывая неблагоприятные последствия для него в виде задержки внутриутробного развития, самопроизвольных абортов или аномалий развития.
При исследовании гистопрепаратов плаценты, полученных из аборт-плодов свиноматок с клиническими признаками ЦВС-2, было выявлено следующее.
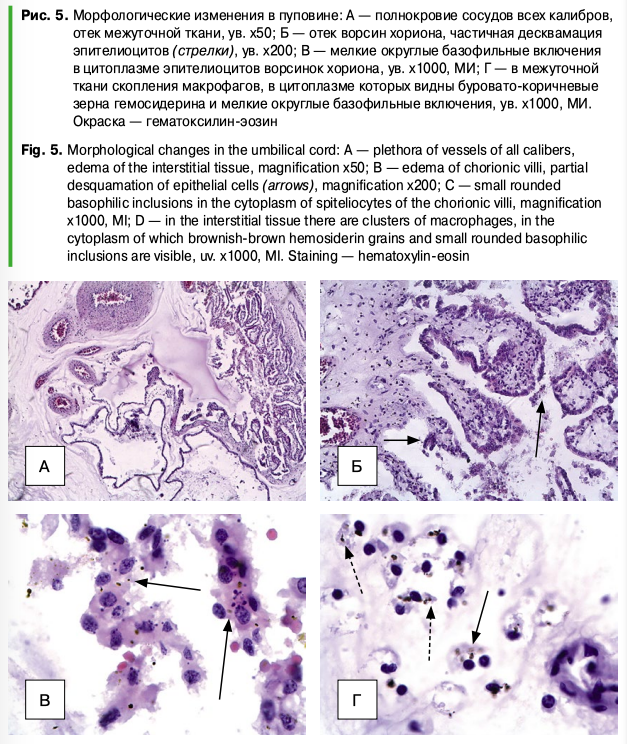
Во всех полях зрения — венозное и капиллярное полнокровие (рис. 5А). Ворсинки хориона отечные, набухшие, межуточная ткань разволокнена, отечна (рис. 5Б). Эпителий ворсин хориона в состоянии белковой дистрофии, частично десквамирован (рис. 5Б).
На большом увеличении видны многочисленные мелкие округлые базофильные включения в цитоплазме (рис. 5В) эпителиоцитов ворсинок хориона. В межуточной ткани выявляются скопления макрофагов с включениями в цитоплазму как зерен гемосидерина, так и округлых базофильных телец (рис. 5).
Обсуждение
Цирковирус свиней 2-го типа (ЦВС-2) вызывает большие экономические потери в промышленном свиноводстве. Одним из проявлений болезни является репродуктивная недостаточность, преимущественно связанная с увеличением количества поздних абортов, мумифицированных, мертворожденных и нежизнеспособных поросят при рождении, а также с эмбриональной смертностью.
В исследовании приведены результаты микроскопического исследования органов аборт-плодов, полученных от свиноматок с клиническими признаками ЦВС-2, несмотря на проведение плановых вакцинаций против цирковируса. Наиболее вероятным источником внутриутробной инфекции, вызывающим репродуктивные потери, является цирковирусная инфекция, протекающая в организме свиноматок в субклинической форме. Способность ЦВС-2 проникать через плаценту у свиноматок на поздних сроках беременности доказана в ряде экспериментальных исследований, однако она может значительно снижаться за счет вакцинации свиноматок против ЦВС-2.
В данных исследованиях о вирусной причине абортов свидетельствуют особенности микроскопической картины препаратов плаценты и пуповины, в которых выявлены макрофаги с включениями в цитоплазме. Согласно данным, их появление в клетках данных органов свидетельствует о вирусной природе плацентарной недостаточности и клеточных повреждениях. В исследованиях также сообщалось о сопряженности такого гистологического признака, как активность макрофагальной реакции с вирусным агентом. При этом проявление плацентарной недостаточности при цирковирусной инфекции сопряжено с состоянием организма материи и отражается на росте и развитии плода.
Антигены цирковируса 2-го типа являются причиной негнойных нектротизирующих повреждений тканей у мертворожденных поросят, а также истощения клеток селезенки и инфильтрации печени. Гистопатологический анализ тканей печени аборт-плодов от свиноматок с клиническими признаками ЦВС-2 показал, что в органе развивающегося плода модифицирована функция кроветворения, о чем свидетельствуют эритростаз, отделение плазмы от форменных элементов и наличие гемолизированных эритроцитов в местах кровоизлияний, а также формирование печеночной стромы как результат инфильтрации тканей, развития дистрофии и некроза гепатоцитов. Тропность цирковируса к гепатоцитам подтверждена в исследованиях. При этом степень и выраженность повреждения клеток печени сопряжены с количеством и распределением ЦВС-2 в тканях органа.
Помимо печени, цирковирус у плода проявляет тропность к клеткам селезенки, сердца, легких и лимфатическх узлов.
Так, в селезенке аборт-плодов были выявлены застойные явления, кровоизлияния, а также лимфоидные повреждения, свидетельствующие об иммуносупрессии. Cледовательно, уже в период внутриутробного развития у плода в организме свиноматок с клиническими признаками ЦВС-2 развиваются поражения, характерные для цирковирусной инфекции поросят и являющиеся результатом формирования воспалительных процессов в лимфатических узлах, печени и селезенке. В исследованиях отмечено, что развитие цирковируса отражается на функциональном состоянии клеток селезенки как результат развития в органе некротических процессов.
При цирковирусной инфекции наблюдаются изменения и в головном мозге, являющиеся результатом отека нервных клеток. Аналогичные изменения выявлены и при исследовании гистологических препаратов головного мозга аборт-плодов свиноматок с клиническими признаками ЦВС-2. Они являются причиной нарушений в формировании нейронной сети в организме внутриутробно развивающихся поросят.
Таким образом, репродуктивные потери при субклиническом течении цирковирусной инфекции, протекающей на фоне систематической вакцинации свиноматок, сопряжены с поражением метаболически и иммунологически активных органов и тканей развивающегося плода, что является результатом проникновения вируса через фетоплацентарный барьер из организма матери.
Выводы
Результаты исследований, основанные на анализе микроскопических изменений в печени, селезенке, головном мозге, пуповине и плаценте аборт-плодов свиноматок с выраженными клиническими признаками ЦВС-2, показывают, что внутриутробный рост и развитие плода зависят от состояния организма матери. При этом вирус циркулирует не только в организме матери, но и посредством инфицирования пуповины и плаценты поступает в плод, в котором проявляет тропность по отношению к клеткам печени, селезенки и головного мозга. Инфицирование данных органов служит причиной развития в них воспалительных, дистрофических и некротических процессов. Это не позволяет в период внутриутробного развития сформировать морфологические свойства и функциональную активность клеток печени, селезенки и головного мозга плода, инициируя прерывание беременности.
Исследование продемонстрировало потенциальную роль цирковирусной инфекции в формировании репродуктивной функции у свиноматок в промышленных условиях. Результаты исследований расширяют представление о патогенезе заболеваний, ассоциированных с цирковирусом, а также определяют необходимость проведения дальнейших исследований по разработке мероприятий, снижающих репродуктивные потери.
Об авторах
Павел Валерьевич Бурков, кандидат ветеринарных наук, руководитель научно-исследовательского центра биотехнологии репродукции животных. Южно-Уральский государственный аграрный университет, ул. Гагарина, 13, Троицк, Челябинская обл., 457100, Россия
burcovpavel@mail.ru; https://orcid.org/0000-0001-7515-5670
Марина Аркадьевна Дерхо, доктор биологических наук, профессор, Южно-Уральский государственный аграрный университет, ул. Гагарина, 13, Троицк, Челябинская обл., 457100, Россия
derkho2010@yandex.ru; https://orcid.org/0000-0003-3818-0556
Максим Борисович Ребезов, доктор сельскохозяйственных наук, профессор;
• Федеральный научный центр пищевых систем им. В.М. Горбатова Российской академии наук, ул. Талалихина, 26, Москва, 109316, Россия;
• Уральский государственный аграрный университет, ул. Карла Либкнехта, 42, Екатеринбург, 620075, Россия
rebezov@ya.ru; https://orcid.org/0000-0003-0857-5143
Павел Николаевич Щербаков, доктор ветеринарных наук, профессор кафедры инфекционных болезней и ветеринарно-санитарной экспертизы, Южно-Уральский государственный аграрный университет, ул. Гагарина, 13, Троицк, Челябинская обл., 457100, Россия
scherbakov_pavel@mail.ru; https://orcid.org/0000-0001-8685-4645
УДК 636.5.033 DOI: 10.32634/0869-8155-2023-373-8-27-35
Сельское хозяйство, ветеринария, зоотехния, агрономия, агроинженерия, пищевые технологии





















