Сравнительная генетическая характеристика микросателлитного профиля голштинизированных и чистопородных холмогорских быков

Холмогорская порода крупного рогатого скота считается одной из старейших и наилучших отечественных пород. Формирование данной группы животных происходило в условиях европейского Севера, поэтому порода хорошо приспособлена к суровому климату и скудному неполноценному кормлению при относительно неплохих показателях молочной продуктивности. Улучшение хозяйственно полезных признаков породы на данный момент осуществляется главным образом путем скрещивания с голштинским скотом.
Использование мирового генофонда для улучшения продуктивных показателей скота отечественной селекции привело к сокращению поголовья ряда пород, в том числе и холмогорской. Республика Коми — единственный из регионов России, где в наибольшей степени сохранился генофонд чистопородного и низкокровного по голштинам отечественного холмогорского скота. Однако по причине уменьшения численности оставшиеся разрозненные стада утрачивают способность к эффективному воспроизводству и селекции. Стоит отметить, что сокращение количества особей в популяции приводит к нарастанию вероятности инбридинга и повышению гомозиготности генов, что требует разработки особых мероприятий, направленных на сохранение не только самих животных, но и их генетического разнообразия.
Изучение генетических параметров является одним из способов оценки состояния популяции. С этой позиции наиболее удобными и доступными маркерами для проведения генетического анализа можно считать микросателлиты (STR-маркеры, короткие тандемные повторы), что обусловлено высоким уровнем их полиморфизма и повторяемости результатов генотипирования. Так, STR-маркеры применяют для молекулярно-генетического сравнения линий и семейств, оценки генетического разнообразия, стабильности пород и отдельных популяций, при маркировании генотипов, контроле происхождения, изучении потоков генов. Микросателлиты могут сочетаться с маркерами полиморфизма структурных или митохондриальных генов.
Цель исследований — провести сравнительный анализ аллелофонда ДНК-микросателлит у голштинизированных и чистопородных быков-производителей в Республики Коми.
Материал и методы исследования
Исследования выполнены в 2022–2023 гг. в отделе «Печорская опытная станция» ФИЦ Коми НЦ УрО РАН (Сыктывкар, Республика Коми, Россия). Материалом для генетической экспертизы служила криоконсервированная сперма быков-производителей, принадлежащих РГУСП «Коми» по племенной работе (г. Сыктывкар). Всего для ДНК-анализа были отобраны образцы от 64 чистопородных и 36 с различным уровнем голштинизации холмогорских быков-производителей. Чистопородные быки относились к 12 генеалогическим линиям, а помесные производители — к 5 холмогорским и 3 линиям голштинской породы.
Молекулярно-генетические исследования проведены в лаборатории ДНК-технологий Всероссийского научно-исследовательского института племенного дела (г. Пушкино). Выделение ДНК проводили с использованием колонок Nexttec (Nexttec™ Biotechnologie GmbH, Германия) в соответствии с рекомендациями производителя. Микросателлитный профиль коров изучали с помощью ДНК-анализатора с лазерным детектором ABI3130xl (Applied Biosystema, США).
ПЦР анализ выполнен по 15 STR-локусам: BM1818, BM1824, BM2113, CSRM60, CSSM66, ETH10, ETH225, ETH3, ILSTS6, INRA23, SPS115, TGLA122, TGLA126, TGLA227, TGLA53. При генетической оценке определяли среднее число аллелей на локус (Na), их частоту (q), ошибку частот (Mq), степень наблюдаемой (Ho) и ожидаемой (He) гетерозиготности, число эффективных аллелей (Ne), количество приват-аллелей и сумму их частот (Σ q), индексы фиксации (Fis) и Шеннона (I), коэффициенты генетического сходства (r) и генетического расстояния (d) между выборками.
Статистический анализ проведен по общепринятым в биологии и зоотехнии методикам с использованием программы RusExcel.
Результаты и обсуждение
Анализ аллелофонда STR-маркеров показал (табл. 1), что по локусу BM1818 наиболее распространенной (как среди чистопородных, так и помесных животных) являлась аллель 266. Локус BM1824 характеризовался максимальной встречаемостью аллели 188 у голштинизированных быков (q = 40,54), тогда как у чистопородных производителей в 1,8 раза чаще встречался микросателлит 182 (q = 40,48, р ≤ 0,01). STR 137 локуса BM2113 была наиболее распространенной в обеих выборках, однако у чистопородных быков частота аллели была выше в 1,6 раза (р ≤ 0,05). По локусу CSRM60 чаще встречались микросателлиты 92 (q = 31,08 и q = 31,75) и 102 (q = 35,14 и q = 30,16), по локусу CSSM66 у поместных животных максимальное распространение получила аллель (q = 28,38), а у чистопородных — 193 (q = 30,16), которая встречалась в 2,5 раза чаще по отношению к голштинизированным производителям (р ≤ 0,001). Локус ETH3 характеризовался преобладанием аллели 113 (q = 33,78 и q = 32,54), ETH225 — 150 (q = 36,49 и q = 47,62). По локусу ETH10 чаще встречались микросателлиты 219 (q = 51,35 и q = 55,56), при этом частота аллели 217 у чистопородных быков была ниже почти в 4 раза (p ≤ 0,01) по сравнению с помесными. Наиболее распространенным STR-маркером по локусу SPS115 являлся повтор 248 (q = 56,76 и q = 60,32), по локусу ILSTS6 — 292 (q = 43,24 и q = 34,92), по TGLA126 — 117 (q = 50,00 и q = 45,24). Локус INRA23 характеризовался преобладанием микросателлита 206 (q = 31,08 и q = 30,95), при этом аллель 212 данного локуса у голштинизированных животных встречалась в 2,5 раза реже по сравнению с чистопородными быками (p ≤ 0,05). У помесных быков по локусу TGLA53 чаще встречался STR 160 (q = 32,43), а у чистопородных — 162 (q = 20,63), при этом встречаемость аллели 166 у данной группы была в 2,5 раза выше (p ≤ 0,05). Локус TGLA122 характеризовался преобладанием микросателлитa 143, который у чистопородных быков встречался в 1,9 раза чаще (р ≤ 0,001). Наиболее распространенной по локусу TGLA227 являлась аллель 89 (q = 22,97 и q = 28,57), а микросателлит 95 данного локуса у чистопородных быков имел частоты в 8,8 разa выше по сравнению с помесными (p ≤ 0,001).
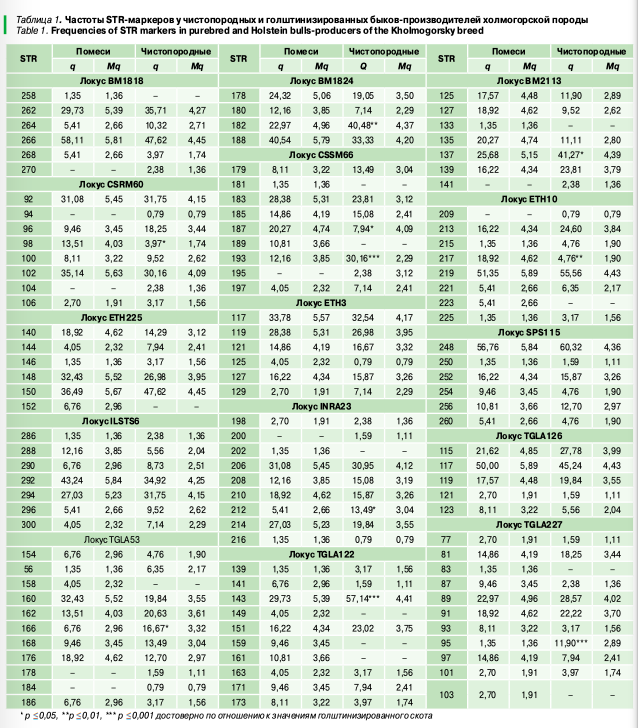
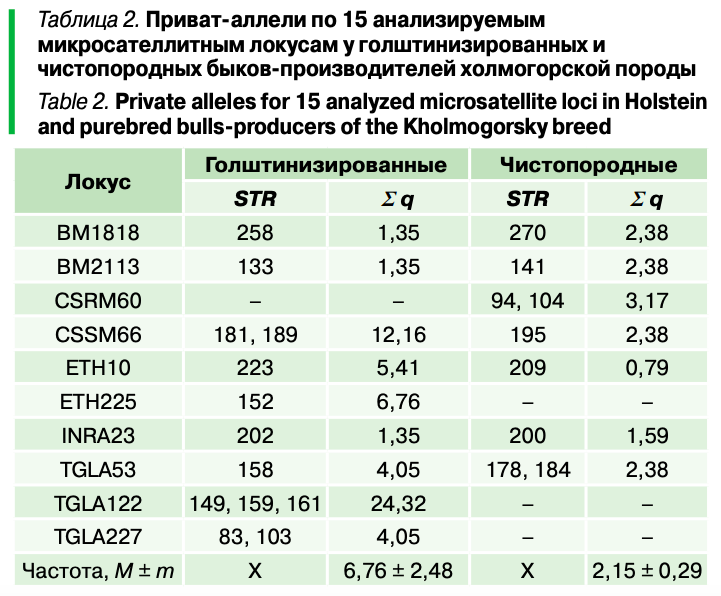
Анализ аллелофонда показал, что среди чистопородных быков встречается 9 микросателлит, не выявленных у помесных животных (табл. 2), средняя частота которых составила 2,15%. У голштинизированных производителей установлено 13 приват-аллелей средней распространенностью 6,76%. Особо стоит отметить микросателлиты 189 локуса CSSM66, 159 и 161 локуса TGLA122, которые очень часто встречалась у помесных производителей (q = 9,46–10,81), но не регистрировались у чистопородных быков.
Наиболее полиморфными (табл. 3) среди голштинизированных животных были локусы TGLA122 (Na = 10) и TGLA227 (Na = 11), а среди чистопородных — TGLA227 (Na = 9) и TGLA53 (Na = 10). Наименьшее количество STR-маркеров у быков двух групп присутствовало по локусу BM1824 (Na = 4). В среднем у помесных производителей наблюдалось незначительное превосходство фактического числа аллелей (на четыре варианта). Распространенность микросателлитов с частотой 10% и более у помесных быков была максимальной по локусам BM2113 и CSSM66 (по пять аллелей), а минимальная — по BM1818 (две аллели). Среди чистопородных животных данный показатель характеризовался наибольшим значением по локусам INRA23 и TGLA53 (по пять аллелей) и наименьшим — по ETH10, ETH10, ILSTS6 и TGLA122 (по две аллели). Число эффективных аллелей было минимальным по локусу BM1818 (Ne = 2,31) у голштинизированных и по SPS115 (Ne = 2,44) у чистопородных быков, а максимальным — по TGLA122 (Ne = 6,29) и TGLA53 (Ne = 6,59) соответственно. В среднем у помесных животных количество эффективных аллелей было незначительно выше (на 0,25). Наибольшее соответствие числа фактических и эффективных аллелей наблюдалось по локусу BM1824 (1,16 у помесных быков и 1,27 — у чистопородных), а наименьшее — по TGLA227 (3,68 и 2,92).
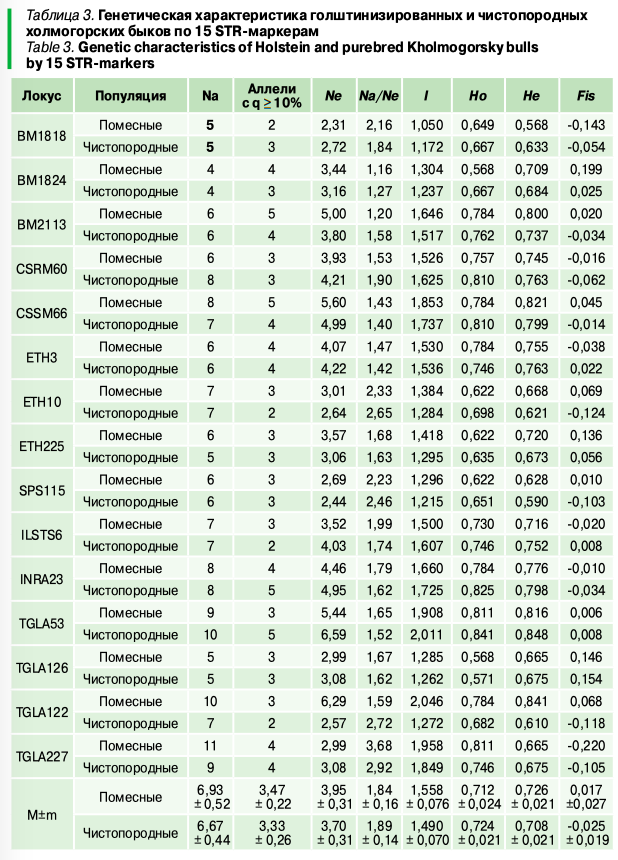
Наибольшее генетическое разнообразие наблюдалось по локусу TGLA122 (I = 2,046) у помесных и по TGLA53 (I =2,011) у чистопородных быков, а наименьшее — по BM1818 (I = 1,050 и 1,174). В среднем у голштинизированных животных разнообразность аллелофонда анализируемых локусов была незначительно выше. Максимальная наблюдаемая гетерозиготность у голштинизированных производителей в равной степени наблюдалась по локусам TGLA227 и TGLA53 (Ho = 0,811), а у чистопородных — только по TGLA53 (Ho = 0,811). Наиболее огомозигоченными локусами у помесных быков можно считать BM1824 и TGLA126 (Ho = 0,568), а у чистопородных — TGLA126 (Ho = 0,571), при этом средний показатель гетерозиготности у данной группы животных был незначительно выше. Ожидаемая гетерозиготность у помесей была максимальной по локусу TGLA122 (Hе = 0,841), а минимальная — по BM1818 (Hе = 0,568), у чистопородных быков максимальная по TGLA53 (Hе = 0,848), минимальная — по SPS115 (Hе = 0,590).
Анализ соответствия наблюдаемой и ожидаемой гетерозиготности показал, что у голштинизированных быков выраженный избыток гетерозигот просматривается по локусу TGLA227 (Fis = -0,220), а дефицит — по BM1824 (Fis = 0,199). Для чистопородных производителей избыток гетерозигот был характерен для локуса ETH10 (Fis = -0,124), а дефицит — для TGLA126 (Fis = 0,154). В среднем индекс фиксации у помесей отклонялся в сторону незначительного дефицита гетерозиготности (0,017), а у чистопородных быков — избытка (-0,025).
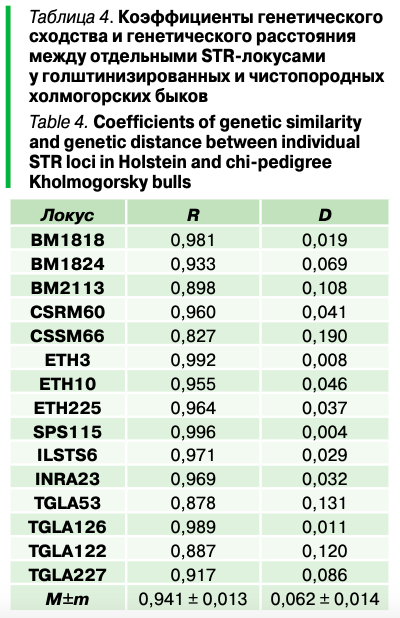
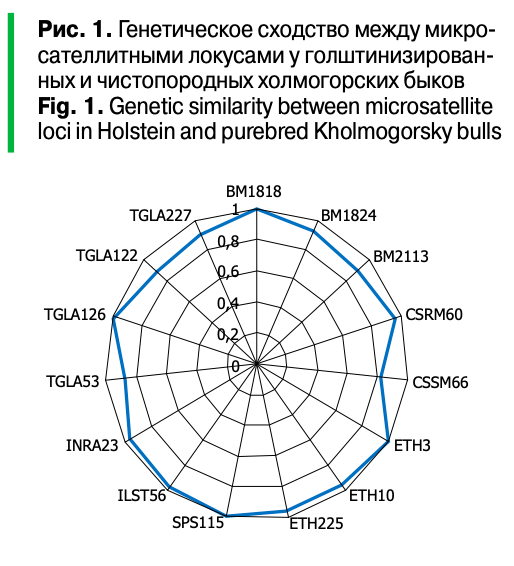
Наибольшее генетическое родство (табл. 4, рис. 1) между двумя выборками наблюдалось по локусу SPS115 (r = 0,996), а наименьшее — по CSSM66 (r = 0,827). Средний коэффициент генетического сходства между помесными и чистопородными быками составил 0,941 ± 0,013.
Выводы
Метизация холмогорского скота голштинским, по всей видимости, привела к элиминации отдельных аллелей и появлению ранее не регистрируемых вариантов ДНК-микросателлитов у данной группы животных. Несмотря на большее количество генеалогических линий у чистопородных производителей, холмогорские быки по аллельной структуре STR-маркеров оказались генетически менее разнообразны, что, по всей видимости, обусловлено сокращением численности животных отечественной селекции. Вместе с тем смещение индекса фиксации у чистопородных производителей в сторону избытка фактической гетерозиготности указывает на минимальную вероятность инбридинга на данном этапе разведения. Таким образом, полученные данные позволяют оптимизировать мероприятия, направленные на сохранение аллельного разнообразия исчезающего генофонда холмогорского скота.
Об авторах
Семен Викторович Николаев, кандидат ветеринарных наук, научный сотрудник, Институт агробиотехнологий им. А.В. Журавского Коми научного центра Уральского отделения Российской академии наук, ул. Ручейная, 29, Сыктывкар, 167023, Россия
semen.nikolaev.90@mail.ru; https:.orcid.org/0000-0001-5485-4616
Владимир Леонтьевич Ялуга, кандидат биологических наук, старший научный сотрудник, Федеральный исследовательский центр комплексного изучения Арктики им. академика Н.П. Лаверова Уральского отделения Российской академии наук, пр-т Никольский, 20, Архангельск, 163020, Россия
yaluga29@yandex.ru; https:.orcid.org/0000-0002-0215-9715
УДК 636.2.034:575.17 DOI: 10.32634/0869-8155-2023-372-7-58-62
Сельское хозяйство, ветеринария, зоотехния, агрономия, агроинженерия, пищевые технологии





















