Управляемая коацервация антиоксидантов как способ получения функциональных пищевых ингредиентов повышенной биодоступности

Стратегией развития пищевой и перерабатывающей промышленности на период до 2030 года в числе ключевых целей обозначена необходимость увеличения производства обогащенной и специализированной пищевой продукции, которая бы позволила снижать уровень негативного внешнего влияния на организм человека, а также минимизировать риски алиментарно-зависимых заболеваний.
В этом ключе возрастает роль научного развития направления получения функциональных пищевых ингредиентов с доказанной эффективностью, в том числе антиоксидантного действия. Одним из возможных направлений решения этой задачи является использование технологий инкапсуляции известных и хорошо изученных антиоксидантов для их защиты от внешних агрессивных факторов воздействия и получения, таким образом, эффективных функциональных ингредиентов с повышенным уровнем биодоступности и биоактивности.
Куркумин — природный полифенол, содержащийся в корневищах Curcuma longaL. (Zingiberaceae), является одним из многообещающих природных соединений, используемых для профилактики и лечения воспалительных заболеваний. Куркумин обладает также выраженными антиоксидантными свойствами и способен модулировать активность ключевых факторов транскрипции, связанных с воспалением, таких как ядерный фактор κB (NF-κB).
В открытой литературе представлен достаточно весомый пласт исследований, подтверждающих такие свойства куркумина, как противораковые, противовоспалительные, антибактериальные и свойства нейропротекции. Кроме того, куркумин признан Всемирной организацией здравоохранения (ВОЗ) и Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) как диетическая пищевая добавка. Однако практическое применение куркумина в качестве биологически активного ингредиента в функциональных продуктах питания было ограничено, что связано с его низкой биодоступностью, чрезвычайно низкой растворимостью в воде, а также с его быстрой деградацией и плохой абсорбцией. Для минимизации этих барьерных факторов сегодня предлагаются такие подходы, как микрокапсулирование куркумина.
Среди недорогих и доступных методов микрокапсулирования можно выделить технологию коацервации, при которой инкапсулируемое вещество, находящееся в фазе суспензии, покрывается тонкой нерастворимой оболочкой биополимера.
Сложности применения технологий инкапсуляции для получения пищевых ингредиентов обусловлены необходимостью использования приемлемых для пищевой промышленности сырья и подходов. При коацевации в качестве полимеров обычно используются макромолекулы белков и углеводов (желатин, пектин и др.), что допустимо для пищевых производств.
Коацервация позволяет получить продукт в виде порошка или суспензии с размером частиц от 10 до 800 мкм в зависимости от инкапсулируемых биологически активных веществ и используемых биополимеров. Оболочка капсулы нерастворима и разрушается только в результате механического воздействия.
В основе процесса коацервации лежит электростатическое взаимодействие в коллоидной системе, в результате которого происходят агрегация молекул биополимеров и формирование капсул. Тригерным фактором воздействия, определяющим силу электростатического притяжения, является рН системы.
Цели исследования — оценка влияния регулирования рН системы на выход капсул, эффективность загрузки куркумина и свойства инкапсулированного антиоксиданта.
Материалы и методы исследований
В качестве биологически активного вещества был использован растительный антиоксидант куркумин (производитель Octacosanol, Jiangsu, China).
Ключевые свойства куркумина как биологически активного вещества с учетом правила Липински представлены в табл. 1
Для получения коацерватов использовали желатин говяжий пищевой П-160 (изготовитель ОАО «Можелит», Республика Беларусь), пектин цитрусовый высокоэтерефицированный (степень этерификации выше 50) (HSC 105, Китай).
Определяли значение рН, наиболее благоприятное для формирования биополимерных капсул. Для этого первоначально готовили индивидуальные растворы каждого биополимера при рН 7,0. Смешивание же растворов полимеров проводили, снижая значения рН с использованием 1 моль/л HCl в диапазоне 6,0–2,0 с шагом 0,5.
На первом этапе исследований оценивали выход коацервированных капсул в сухом виде, определяли после высушивания по формуле (Kaushik et al., 2016):
X% = (СВс)/(СВисх) × 100%, (1)
где СВс и СВисх — масса порошка, полученного после сушки, и начальная масса пектина и желатина, используемых для коацервации, соответственно.
Эффективность инкапсуляции (ЭИ) куркумина определяли как отношение вещества, инкапсулированного к количеству вещества, оставшегося на поверхности капсул, по методике.
Эффективность инкапсуляции (в %) рассчитывали по формуле:
ЭИ (%) = Х1 — Х0 / Х2 х 100, (2)
где: Х1 — общее количество куркумина (после процедуры разрушения капсул), мг; Х0 — количество неинкапсулированного куркумина, мг; Х2 — количество куркумина, добавленного при инкапсуляции, мг.
Куркумин для инкапсуляции вносили в раствор желатина в массовых соотношениях «куркумин — желатин», равных 0,1:1, 0,5:1, 1:1, 1,5:1.
Общую антиоксидантную (антирадикальную) активность (АОА) куркумина определяли методом DPPH, после процедуры переваривания — по методике. Для сравнения в качестве контрольного образца использовали неинкапсулированный куркумин (в исходной форме).
Статистическая обработка результатов исследования проводилась с применением общепринятых методов, полученные результаты считали достоверными при р ≤ 0,05.
Результаты исследований
Комплексная (или сложная) коацервация представляет собой специфический тип комплексообразования, при котором ключевую роль в формировании полимерных капсул играет электростатическое взаимодействие. Это явление взаимодействия белков и полисахаридов, которое происходит в смеси растворов противоположно заряженных биополимеров из-за сил притяжения или формирования водородных связей. Таким образом, этот процесс можно контролировать, меняя природу используемых биополимеров, состав растворов и значение рН системы. При создании необходимых условий образуются нерастворимые комплексы между биополимерами, которые могут использоваться для инкапсуляции, защиты и эффективной доставки биологически активных компонентов.
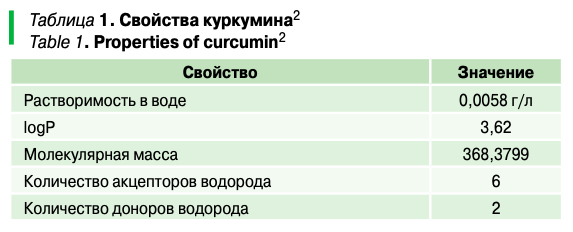
Результаты определения количества (выхода, %) капсул в зависимости от значения рН, используемого для процесса коацервации, представлены на рисунке 1.
Известно, что высокоэтерефицированный пектин преимущественно состоит из остатков галактуроновой кислоты и имеет отрицательный заряд из-за присутствия ионизированных карбоксильных групп вдоль его основной цепи. Однако при снижении pH раствора карбоксильные группы пектина постепенно протонируются и заряд становится менее отрицательным.
Желатин является амфотерным полиэлектролитом, полученным в результате частичного гидролиза коллагена, структуру желатина формируют повторяющиеся последовательности глицина с пролином и гидропролином. Молекулы желатина могут обладать различными физическими характеристиками, и желатин может нести как суммарный положительный, так и отрицательный заряд. Именно это определяет необходимость подбирать значения рН для активации электростатического взаимодействия и запуска процесса коацервации.
Как правило, растворимые однофазные комплексы белков и полисахаридов образуются, когда электростатические взаимодействия довольно слабы, а общий заряд относительно высок, тогда как сложные коацерваты образуются, когда электростатические взаимодействия сильнее, а общий заряд низок.
Исследования показали, что наиболее высокий выход коацервированных капсул наблюдается при значениях рН 3 и 3,5, 71,5% и 66,1% соответственно.
На следующем этапе исследований проводили инкапсуляцию куркумина в желатин-пектиновые капсулы, используя комплексную коацервацию. Для запуска процесса коацервации использовали формирование рН системы, равное 3.
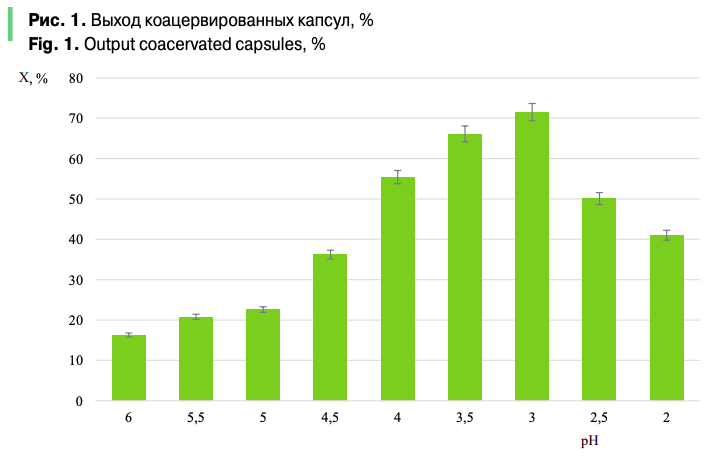
Результаты определения эффективности инкапсуляции куркумина в зависимости от количества вносимого БАВ представлены на рис. 2.
Максимальные значения эффективности инкапсуляции куркумина в используемых условиях составили 46,1%, что было ниже ожидаемых значений и, вероятно, обусловлено низкой растворимостью куркумина в воде (табл. 1) и его способностью к агломерации частиц, что усложняет процесс инкапсуляции. Очевидно, для увеличения эффективности инкапсуляции куркумина процесс растворения биополимеров желательно проводить в органических растворителях, например спирте. Соответственно, это требует и подбора иных биополимеров.
Наиболее высокий уровень эффективности инкапсуляции был достигнут при соотношении «куркумин — желатин», равном 1:1. При использовании меньшего количества куркумина эффективность инкапсуляции значительно снижалась. Избыточное по отношению к желатину количество куркумина приводило к неустойчивому процессу коацеварвации, что, вероятно, связано с влиянием куркумина на изменение силы электростатического взаимодействия в системе «желатин — пектин».
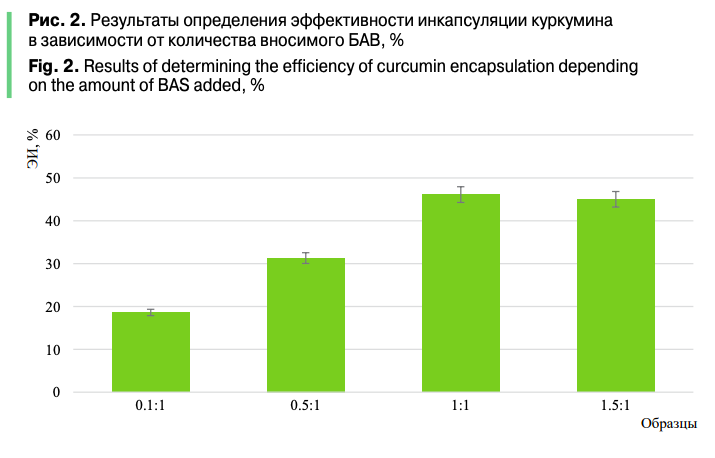
На заключительном этапе исследований была оценена целесообразность используемого подхода для обеспечения защиты и увеличения биодоступности куркумина в процессе его доставки в организм человека. Куркумин в исходной форме и инкапсулированный (использовали предварительно лиофильно высушенный образец инкапсулированного куркумина, при получении которого соотношение «куркумин — желатин» составляло 1:1) подвергали процедуре переваривания in vitro. В полученных переваренных фракциях определяли значения АОА DPPH методом (результаты представлены на рис. 3).
Результаты показали, что антиоксидантная активность куркумина в дистиллированной воде составляет 58,9%, что обусловлено выраженной гидрофобностью вещества. Вместе с тем после процесса переваривания куркумин теряет свои антиоксидантные свойства практически вдвое. Это обусловлено его невысокой стойкостью к действию ферментов, сильно кислым условиям (рН = 2–2,5 в желудочной фазе), резкому изменению рН при переходе в фазу кишечника (рН = 7). Воздействие стрессовых факторов приводит к потере количества куркумина в биоактивной форме.
Известно, что антиоксидантные свойства куркумина обусловлены последовательной потерей протонов и переносом электронов. Связывание куркумина с белком (желатином) посредством гидрофобного взаимодействия может способствовать переносу электрона, что увеличивает антиоксидантные свойства комплекса. Кроме того, в процессе пищеварения белково-полисахаридная капсула защищает значительную часть куркумина от внешних стрессовых воздействий. Всё это в комплексе обеспечило сохранение антиоксидантных свойств инкапсулированного куркумина на уровне, близком к куркумину до процесса переваривания.
Выводы
Таким, образом, исследования показали возможность регулирования процесса коацервации путем изменения значений рН. Так, использование рН системы, равного 3,0, позволило добиться увеличения выхода коацервированных капсул до уровня более 70%.
Результаты продемонстрировали, что используемые подходы инкапсуляции куркумина в белково-полисахаридные комплексы могут являться эффективными при разработке функциональных ингредиентов с выраженными антиоксидантными свойствами.
Вместе с тем следует отметить, что увеличить эффективность функциональных ингредиентов на основе инкапсулированного куркумина можно, регулируя растворимость биологически активного вещества либо подбирая более подходящие по свойствам для куркумина белки и полисахариды, что в целом требует дополнительных исследований.
Об авторах
Ринат Ильгидарович Фаткуллин, кандидат технических наук, доцент кафедры пищевых и биотехнологий, Южно-Уральский государственный университет, пр. Ленина, 76, Челябинск, 454080, Россия
fatkullinri@susu.ru; https://orcid.org/0000-0002-1498-0703
Ирина Валерьевна Калинина, доктор технических наук, профессор кафедры пищевых и биотехнологий, доцент, Южно-Уральский государственный университет, пр. Ленина, 76, Челябинск, 454080, Россия
kalininaiv@susu.ru; https://orcid.org/0000-0002-6246-9870
Наталья Владимировна Науменко, доктор технических наук, доцент кафедры пищевых и биотехнологий, доцент, Южно-Уральский государственный университет, пр. Ленина, 76, Челябинск, 454080, Россия
naumenkonv@susu.ru; https://orcid.org/0000-0002-9520-3251
Наталия Викторовна Попова, кандидат технических наук, доцент кафедры пищевых и биотехнологий, Южно-Уральский государственный университет, пр. Ленина, 76, Челябинск, 454080, Россия
nvpopova@susu.ru; https://orcid.org/0000-0001-7665-5984
Екатерина Евгеньевна Науменко, студент, Южно-Уральский государственный университет, пр. Ленина, 76, Челябинск, 454080, Россия
9193122375@mail.ru; https://orcid.org/0000-0002-0213-1595
Ева Иванисова, PhD, доцент, Институт пищевых наук, Словацкий сельскохозяйственный университет, 2 Триеда Андрея Глинка, Нитра, 94976, Словакия
eva.ivanisova@uniag.sk; https://orcid.org/0000-0001-5193-2957
Eлизавета Константиновна Васильева, студент,Российский университет транспорта (МИИТ), ул. Образцова, д. 9, стр. 9, Москва, 127994, Россия
VasilevaE.04@mail.ru; https://orcid.org/0009-0000-9559-8137
УДК 664+661.123 DOI: 10.32634/0869-8155-2023-371-6-116-120
Сельское хозяйство, ветеринария, зоотехния, агрономия, агроинженерия, пищевые технологии





















