Оценка антимикробного воздействия нетермальной СВЧ-плазмы в модельном эксперименте

Ключевая задача всей пищевой промышленности — это производство не только качественных, но и безопасных для потребителей продуктов питания. Для достижения поставленной задачи необходимо обеспечить полное отсутствие патогенной микрофлоры, а также низкое содержание количества мезофильных аэробных и факультативно анаэробных микроорганизмов (КМАФАнМ) в пищевых продуктах. Для повышения биологической безопасности продуктов питания предпринимаются значительные усилия, тем не менее в продукты все еще могут попадать микроорганизмы на разных этапах производства и приспосабливаться к различным условиям окружающей среды. Например, большинство употребляемых в пищу фруктов и орехов как выращиваются, так и производятся чаще всего с нарушением санитарно-гигиенических норм в развивающихся странах. В связи с этим данные продукты имеют высокий уровень естественного загрязнения микроорганизмами, вызывающими порчу, а также патогенными бактериями и грибами. Кроме того, при производстве сухофруктов и орехов сушка осуществляется на открытом воздухе, усиливая риски контаминации почвенными бактериями и плесневыми грибами. Поскольку орехи и сухофрукты — это те виды пищевой продукции, которые могут быть использованы в пищу без предварительной термической обработки, очень актуально обеспечение микробиологической безопасности, что особенно актуально для людей с иммунодефицитами.
Представляется перспективным внедрение газоразрядного метода на основе нетермальной плазмы при близком к атмосферному давлении для стерилизации такой продукции, как сухофрукты, орехи и готовые к употреблению свежие фрукты и овощи. Данный метод обладает рядом значительных преимуществ: позволяет стерилизовать термочувствительные материалы, а длительность воздействия на микроорганизмы может быть очень мала (до нескольких минут). При этом стерилизационные установки на основе нетермальной плазмы не являются источником ионизирующего излучения. Интерес к использованию плазменных струй атмосферного давления с целью инактивации бактерий обусловливает существование многочисленных источников для генерации. Однако принцип работы у всех этих источников один и тот же: плазма воспламеняется внутри сопла, имеющего несколько электродов, расширяется за пределы сопла с помощью газового потока и формирует поток активных частиц. Плазменные струи являются наиболее приспособленными для практического применения, могут быть использованы как для обработки небольших объектов, так и для обширных поверхностей.
Широкое применение нетермальной плазмы с целью инактивации микроорганизмов в сельском хозяйстве и пищевой промышленности пока не было достигнуто, что может быть связано со сложным механизмом плазменной стерилизации. В процесс стерилизации вносят свой вклад УФ-излучение, химически активные частицы, энергия заряженных частиц. Сложность представляет также сопоставление результатов инактивации микроорганизмов под воздействием плазмы. Это связано с тем, что при генерации нетермальной плазмы могут использоваться различные разряды. Однако даже при использовании одного и того же типа разряда могут быть различны экспериментальные условия. Бактериальная клетка подвергается воздействию нетермальной плазмы на различных клеточных уровнях, что в результате приводит к ее гибели. Например, для бактерий E. coli сообщается, что механизм инактивации бактерий в неравновесной аргоновой плазме связан с бомбардировкой ионами и электронами, что вызывает эффект травления на поверхности клетки, приводящий к разрушению материала клетки. Вместе с тем данный механизм действует только на грамотрицательные бактерии, которые обладают тонкими внешней мембраной и муреиновым слоем. Грамположительные бактерии лишены внешней мембраны, однако обладают намного более толстым муреиновым слоем, обеспечивающим прочность и жесткость бактериальной клетке. При использовании такого же разряда для инактивации грамположительных бактерий B. subtilis исследователями фиксировались неповрежденные клеточные стенки после плазменной стерилизации.
Лактобациллы представляют собой грамположительные неспорообразующие палочки правильной формы размером 0,5–1,2 мкм и 1,0–10,0 мкм, некоторые их виды содержатся на растениях в большем количестве. Такие пищевые продукты, как орехи, в период роста, сбора урожая, сушки, хранения поражают многочисленные бактерии, в том числе лактобациллы (Lactobacillus spp.). Безусловно, бактерии рода Lactobacillus являются частью нормальной микробиоты человека и животных. Однако они способны приводить к рискам возникновения инвазивных, в том числе оппортунистических, инфекций, особенно у людей с сильно ослабленным иммунитетом, у тяжело больных людей в палатах интенсивной терапии. Также эти бактерии устойчивы к действию ванкомицина и других антибиотиков, в то время как в продуктах, которые употребляются в пищу без обработки, присутствие бактерий группы кишечной палочки не допускается. Присутствие бактерий рода Lactobacillus может стать причиной ложноположительной пробы на среде Кесслера. Кроме того, бактерии рода Lactobacillus могут вызывать порчу пищевых продуктов как на этапе производства, так и на этапе хранения. Lactobacillus, находясь в продуктах питания, изменяют их запах, консистенцию и цвет, вызывая помутнение и ослизнение, образуя биогенные амины. Большинство случаев бактериальной порчи пива и вина связаны с деятельностью Lactobacillus.
Цель исследования —воценке эффекта воздействия плазменной струи аргоновой нетермальной плазмы при атмосферном давлении, генерируемой микроволновым источником, на природную популяцию Lactobacillus в модельном эксперименте.
Материал и методы исследования
Источником аргоновой нетермальной (неравновесной) плазменной струи служил СВЧ-генератор, который создает плазму в атмосфере плазмообразующего газа, индуцированную микроволнами (стримерный разряд), обеспечивая микроволновое излучение на частоте 2,45 ГГц. Данное устройство — источник плазменной струи при атмосферном давлении — создано во ВНИИРАЭ (г. Обнинск) и представлено схематично на рисунке 1.
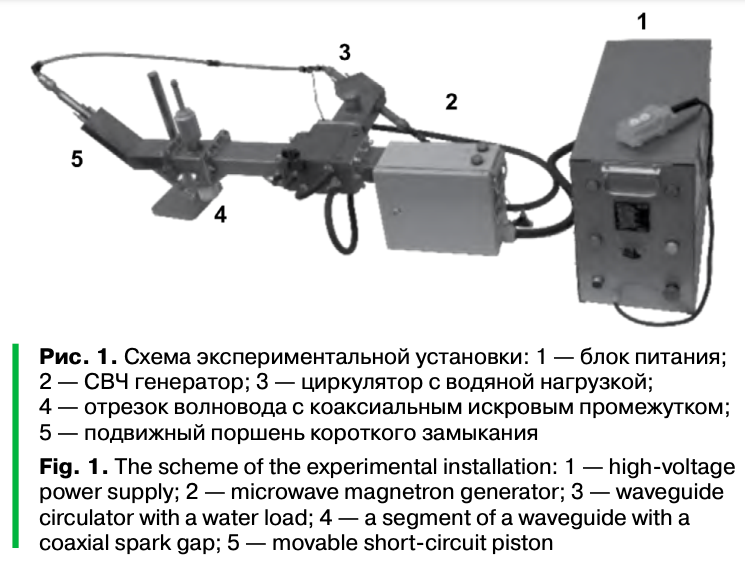
Объект исследования — природная популяция Lactobacillus, выделенная (со смывов) с очищенных грецких орехов. Посев на среду Кесслера проводили по ГОСТ 31747-2012. Положительные пробы пересевали на поверхность агаризованной среды Эндо для дальнейшего подтверждения по биохимическим и культуральным признакам роста принадлежности выделенных колоний. Идентификация бактерий была проведена методом времяпролетной масс-спектрометрии с матрично ассоциированной лазерной десорбцией (ионизацией) (MALDI-TOF MS) на приборе Autoflex speed (Bruker Daltonics, Германия) в Институте биохимии и физиологии микроорганизмов им. Г.К. Скрябина (г. Пущино, Россия). Анализировали колонии, снятые с агара, смешанные с 1 мкл матрицы HCCA (Bruker Daltonics ref: 0,1 г суспендировали в 250 мкл растворителя, состоящего из 2,5% трифторуксусной кислоты в 50% ацетонитрила), нанесенные на мишень из полированной нержавеющей стали (MTP 384) и высушенные на воздухе при комнатной температуре (как требуется в методических указаниях к прибору) [21]. В выделенной природной популяции обнаружены L. plantarum и L. mali. Виды не были разделены, в экспериментах использовалась смешанная культура Lactobacillus.
Ход эксперимента: природную популяцию Lactobacillus выращивали 18 ч на чашке Петри при 37 °С. Затем из выросших Lactobacillus стерильным физиологическим раствором готовили суспензию с титром 107–108 КОЕ/мл. После чего 100 мкл инокулята полученной суспензии засевали сплошным газоном на поверхность агара Эндо. Далее открытые чашки Петри размещали перпендикулярно плазменной струи на 30 мм от выходного отверстия горелки. Длительность экспозиции составила 60 с, 180 с и 360 с при комнатной температуре (23–25 °С). Поток аргона составил 10 л/мин (контролировалось ротаметром для баллонного регулятора расхода газа), температура на поверхности агара Эндо с посевом непрерывно контролировалась с помощью тепловизора SDS HotFind-LT (Hotfind, Китай). После экспозиции Lactobacillus инкубировали при 37 °С в термостате в течение суток. Затем измеряли диаметр зон инактивации роста бактерий. Для контроля были подготовлены чашки с культурой Lactobacillus, на которые после посева не воздействовали плазменной струей. Все варианты эксперимента выполнены в трех повторностях. Незасеянные культурой чашки Петри с питательной средой также обрабатывали плазмой с целью контроля стерильности среды.
Результаты и обсуждение
Выделенная с грецких орехов природная популяция молочнокислых бактерий представляла собой грамположительные палочки, которые даютустойчивый рост на агаре Эндо, образуя красные колонии с металлическим зеленоватым блеском размером 1–2 мм, а также ложноположительный результат на среде Кесслера.
Результаты эксперимента с аргоновой неравновесной плазмой показали, что экспозиция длительностью от 60 до 360 с не приводит к быстрому и полному санирующему эффекту, но умеренно подавляет рост Lactobacillus — так называемое явление контролируемости бактериальной популяции низкой плотности на поверхности плотной питательной среды.
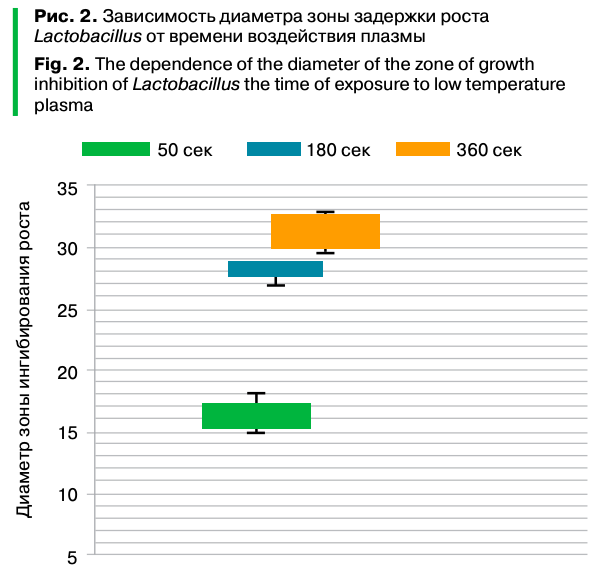
Установлено, что обработка культуры на поверхности питательной среды в течение 60 с не приводила к образованию выраженной зоны подавления роста, хотя наблюдалось небольшое разрежение плотности бактериального газона в области облучения диаметром до 18 мм. Экспозиция в течение 180 с способствовала появлению на поверхности плотной питательной среды зоны подавления роста радиусом 28,6 мм. Дальнейшее увеличение времени плазменной обработки до 360 с приводило к увеличению диаметра зоны подавления роста до 32,7 мм, что соответствовало диаметру видимой плазменной струи, непосредственно взаимодействующей с поверхностью питательной среды. Таким образом, была продемонстрирована прямая зависимость диаметра зоны подавления роста Lactobacillus от времени экспозиции.
Зависимость диаметра зон подавления роста от времени плазменной обработки представлена в таблице 1.
Температура на поверхности питательной среды во время экспозиции нетермальной плазмой была в пределах оптимальной температуры роста Lactobacillus (30–40 °С). Таким образом, можно исключить температурный эффект как фактор ингибирования роста, поскольку для гибели бактерий и микроорганизмов требуются более высокие температуры и продолжительность их воздействия.
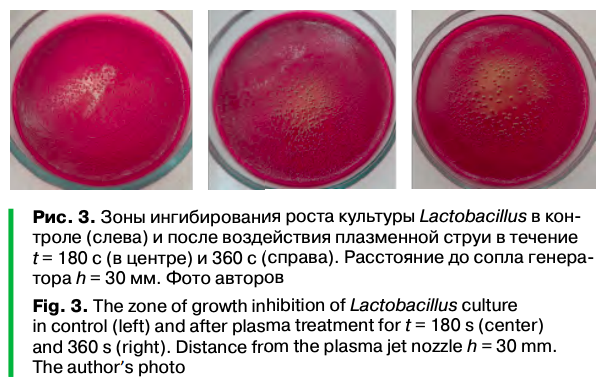
Поверхность плотной питательной среды, засеянной культурой Lactobacillus, спустя 24 ч после экспозиции под плазмой представлена на рисунке 2. Результаты исследования продемонстрировали изменение агара Эндо под воздействием нетермальной плазмы длительностью 180 с и 360 с. Непосредственно в месте воздействия аргоновой плазмы наблюдался зеленый металлический блеск на питательной среде. Данный эффект можно объяснить тем, что фуксинсернистая кислота (реактив Шиффа), которая присутствует в агаре Эндо, при взаимодействии с плазмой окисляется до фуксина.
Согласно литературным данным, микроорганизмы разных таксономических групп обладают различной чувствительностью и устойчивостью к воздействию нетермальной плазмы. Например, при воздействии на E. coli авторы отмечают, что площадь инактивации не ограничивается диаметром сопла генератора, в пределах которого формируются плазменные струи, а с увеличением времени воздействия плазменных струй на поверхность чашек существенно расширяется площадь инактивации. Однако, в отличие от E. coli, для инактивации грамположительных бактерий B. subtilis нетермальной плазмой необходимо увеличить время воздействия до 300 с и уменьшить расстояние до источника плазмы до 5 мм, так как B. subtilis оказались более устойчивы к аргоновой плазме. Зона стерильности для B. subtilis составила 2,8 мм при времени воздействия t = 300 с. Для инактивации роста E. coli было достаточно 120 с.
Результаты исследования показали, что используемый источник плазменной струи может быть применен для стерилизации поверхностей продуктов питания.
Выводы
Грамположительные микроорганизмы — природная популяция Lactobacillus — оказались чувствительными к воздействию аргоновой нетермальной плазмы от СВЧ-генератора плазменной струи. Этот эффект является дозозависимым. Бактерицидный эффект достигался при 180- и 360-секундной экспозиции культивируемых микроорганизмов под плазменной струей. После 180-секундной экспозиции диаметр зоны ингибирования роста бактерий на чашке, то есть зоны, где число бактериальных колоний было ниже, чем в контроле, составил до 28,6 мм. После 360-секундной экспозиции в зоне непосредственного воздействия остаются лишь единичные выросшие колонии, диаметр области ингибирования роста бактерий равен диаметру сопла СВЧ-генератора.
Об авторах
Дарья Игоревна Петрухина, кандидат биологических наук, старший научный сотрудник, Всероссийский научно-исследовательский институт радиологии и агроэкологии, Киевское шоссе, 109-й км, Обнинск, 249032, Россия
daria.petrukhina@outlook.com; https://orcid.org/0000-0002-5790-9958
Владимир Александрович Харламов, кандидат биологических наук, Всероссийский научно-исследовательский институт радиологии и агроэкологии, Киевское шоссе, 109-й км, Обнинск, 249032, Россия
kharlamof@gmail.com; https://orcid.org/0000-0003-3479-1800
Сергей Андреевич Горбатов, научный сотрудник, Всероссийский научно-исследовательский институт радиологии и агроэкологии, Киевское шоссе, 109-й км, Обнинск, 249032, Россия
gorbatovsa004@gmail.com; https://orcid.org/0000-0002-7373-8183
Ибрагим Меджидович Меджидов, аспирант, научный сотрудник, Всероссийский научно-исследовательский институт радиологии и агроэкологии, Киевское шоссе, 109-й км, Обнинск, 249032, Россия
immedzhidov@mail.ru; https://orcid.org/0000-0002-5427-7887
Валентин Игоревич Шишко, научный сотрудник, Всероссийский научно-исследовательский институт радиологии и агроэкологии, Киевское шоссе, 109-й км, Обнинск, 249032, Россия
valentine585@yandex.ru; https://orcid.org/0000-0002-0526-0579
Оксана Владимировна Тхорик, научный сотрудник, Всероссийский научно-исследовательский институт радиологии и агроэкологии, Киевское шоссе, 109 км, Обнинск, 249032, Россия
oxana.tkhorik@gmail.com; https://orcid.org/0000-0001-5213-2150
УДК 66.088: 579.678 DOI: 10.32634/0869-8155-2023-370-5-103-107
Сельское хозяйство, ветеринария, зоотехния, агрономия, агроинженерия, пищевые технологии





















