Практический опыт антибиотикотерапии при патологии суставов у цыплят-бройлеров

При выращивании цыплят-бройлеров ученые и практикующие ветеринарные врачи отмечают, что в структуре бактериальных болезней наиболее часто регистрируются заболевания, вызванные ассоциациями патогенной и условно-патогенной микрофлоры. По данным Wideman Robert F., Prisdy R.D., инфекционными причинами при патологии суставов, в частности некроза головки бедренной кости (НГБК), являются бактерии, представленные на схеме 1.

У цыплят-бройлеров имеется в высокой степени инфицированность органов условно-патогенной микрофлорой, включая E. coli, Staphylococcus spp., Streptococcus spp., Proteus spp., в том числе и патогенную. Восприимчивость цыплят-бройлеров к колибактериозу и стафилококкозу зависит от возраста птицы.
Заболевание чаще возникает у 14–35-дневных цыплят-бройлеров с пиком клинических признаков примерно на 35-й день выращивания. Стратегический успех данных возбудителей зависит от их способности быстро адаптироваться к агрессивному действию эффекторов иммунной системы и антимикробных препаратов. Именно резистентность E. coli, Staphylococcus spp., Streptococcus spp. к антибактериальным препаратамделает данные бактерии лидерами среди оппортунистических микроорганизмов.
Кроме этого, например, Staphylococcus spp., способен колонизироваться в костной ткани, образуя биопленку одновременно с биологическим процессом размножения и образованием многоклеточного слоя (клеточных кластеров), включенного в полимерный матрикс. В составе биопленки данные бактерии становятся недосягаемы для большинства антибактериальных препаратов и являются причиной воспалительных процессов, приводящих к инфекционной патологии суставов.Поэтому возникает необходимость в правильном выборе антимикробных препаратов, чтобы если не ликвидировать, то купировать такие заболевания, как артрит и некроз головки бедренной кости, а для преодоления лекарственной устойчивости бактерий наиболее целесообразным и приемлемым являются сочетанное использование действующих веществ в препарате и рациональное их применение согласно инструкции. Примером этому может служить препарат «Спелинк® 660», содержащий два антибиотических вещества с бактериостатическим эффектом, в состав которых входят действующие вещества линкомицина гидохлорид и спектиномицина гидрохлорид. При совместном применении они обладают взаимоусиливающим действием в отношении многих патогенных микроорганизмов.
Антибиотик из группы линкозамидов линкомицина гидрохлорид действует путем связывания рибосомальными субъединицами 50S чувствительных к препарату микроорганизмов, что приводит к подавлению образования пептидных связей, в зависимости от концентрации препарата в области локализации инфекционного процесса и чувствительности к нему микрофлоры: Гр+: Staphylococcus spp., Streptococcus spp., Mycoplasma spp., Clostridium perfigens. Линкомицина гидрохлорид не проявляет перекрестной устойчивости ни с одним из существующих в настоящее время антибиотиков. Может быть бактерицидным и бактериостатическим в зависимости от чувствительности микроорганизма и концентрации антибиотика.
Спектиномицина гидрохлорид — антибиотик аминоциклитолового ряда, подавляет синтез белков бактерий путем связывания с рибосомальной субъединицей 30S. Обладает активностью в отношении Гр- и Гр+, таких как Escherichia coli, Klebsiella, Proteus, Enterobacter, Streptococci spp., Staphulococcus spp., Mycoplasma spp., Salmonella spp. и др. Обладает преимущественно бактериостатическим действием. Спектиномицина гидрохлорид эффективен в случае резистентности к другим антибиотикам.
Важной особенностью представленного комплексного препарата «Спелинк® 660» является то, что входящие действующие вещества препятствуют распространению и колонизации патогенных бактерий желудочно-кишечного, респираторного трактов и в костной и суставной ткани.
Цель исследования — установить причину развития патологии суставов в виде артритов и НГБК у цыплят-бройлеров кросса Сobb-500 в первые три недели выращивания, особенно после 20-го дня жизни.
На данном предприятии из проб патологического материала цыплят-бройлеров с первых дней откорма выделяли Staphylococcus spp. Возможно, инфицирование происходило в инкубаторе алиментарно или при «вертикальной передаче» — через инкубационное яйцо.
Учитывая, что на предприятии на основании клинических признаков, лабораторных и гистологических исследований от предыдущих партий выращивания птицы и мониторинга выделяемых бактерий с первых дней выращивания цыплятам-бройлерам вводят препараты на основе энрофлоксацина и колистина сульфат по утвержденной ранее схеме лечебно-профилактических мероприятий на предприятии, но при этом в более старшем возрасте, проявляются клинические признаки патологии суставов.
Задача состояла в назначении препарата (действующих веществ — ДВ) или комбинации ДВ, антимикробный спектр которых включает большинство выделенных возбудителей от цыплят-бройлеров, особенно в анатомической области сустава и с учетом устойчивости изолятов к антибактериальным препаратам.
Материалы и методы
В производственном опыте были задействованы две группы цыплят (с суточного возраста до 41-го дня жизни птицы): опытная группа — 407 588 голов и контрольная — 410 966 голов. Группы были подобраны по принципу аналогов с идентичным содержанием, кормлением и программой вакцинации против вирусных болезней. Длительность производственного опыта составляла 41 день.
В ходе производственного опыта отбирали патологический материал для лабораторного исследования, включающего в себя:
• Гистологическое исследование ветеринария выполняли в секторе патоморфологии Всероссийского научно-исследовательского института экспериментальной ветеринарии им. К.И. Скрябина и Я.Р. Коваленко Российской академии наук, г. Москва. Материал доставляли в 10%-ном забуференном растворе формалина (ООО «Биовитрум», Россия). Далее ткани суставов и костей были декальцинированы в электролитном растворе (ООО «Биовитрум», Россия). Затем формировали образцы необходимого размера для помещения в гистологические кассеты. Далее органы пропитывали в автоматической установке карусельного типа фирмы Thermo Scientific (Германия). После пропитывания материал заливали в металлические формы горячим парафином и при помощи гистологических колец формировали блоки на криоконсоле при поверхностной температуре -10ºС Thermo Scientific (Германия). Готовые парафиновые блоки нарезали на роторном микротоме фирмы Thermo Scientific (Германия), толщина срезов составляла 5–6 микрон.
После микротома срезы переносили в водяную баню Microm SB-80 на дистиллированную воду, подогретую до температуры 47ºС. Для необходимой фиксации парафинового среза на предметное стекло наносили глицериновый альбумин по Маллоури. После просушивания гистосрезов на нагревательном столике фирмы Medax (Германия) проводили стандартные гистотехнические мероприятия, направленные на освобождение срезов от парафина и окраску материала, направленную на выявление возможных патологий (окраска гематоксилином и эозином, красители производства ООО «Биовитрум», Россия). Для этой цели использовали автоматическое оборудование линейного типа фирмы Thermo Scientific (Германия). Гистологические срезы оценивали в микроскопе Axio 1.0, фотосъемку вели при помощи фотоаппарата и программы AxioVision.
• Микробиологическое исследование выполняли в Государственном научном центре прикладной микробиологии и биотехнологии (п. Оболенск). Оно включало в себя выделение бактерий из патологических проб суставов и костей птицы, определение чувствительности бактерий к антибиотикам.
Данные исследования проводили согласно стандартным методикам. Патологический материал подвергали анализу на присутствие в них бактерий, принадлежащих семейству энтеробактерий, Streptococcus, Staphylococcus. Для выделения энтеропатогенов использовали агар Эндо, сорбитол агар, ГРМ (ГНЦ ПМБ) и XLD (HiMedia, Индия). Для выделения сальмонелл, помимо «прямого» посева исследуемого материала на указанные питательные среды, использовали предварительное обогащение образцов на неселективной и селективной средах: Buffered Hi Veg Pepton Water, Selenite Broth и Rappoport Vassiliad Soya Broth (HiMedia, Индия).
Стрептококки изолировали на Streptococcus selection Agar (M304, HiMedia), Streptococcus selection Broth (M303, HiMedia), шоколадном агаре на основе FT-агара (ГНЦ ПМБ) с NAD. Стафилококки выделяли, используя специальную среду Staphylococcus agar (HiMedia, Индия). Для идентификации выделенных бактерий использовали микротест-систему Lachema (Чехия), Api (Биомерье, Франция). Также при идентификации микроорганизмов использовали масс-спектральный анализ в режиме MALDI-TOF на масс-спектрометре Bruker с использованием автоматической программы Bruker Taxonomy. Чувствительность культур к антимикробным препаратам определяли методом разведения антибиотиков в жидкой питательной среде (определение минимальной подавляющей концентрации, МПК) с использованием «агарового» метода и дисков «Методические указания по лабораторной диагностике стрептококкоза и стафилококкоза животных (утв. Минсельхозом СССР 25.09.1990)».
• Молекулярно-биологические исследования проводили в ООО «ЭПСИЛОН-БИО» (г. Белгород), включающие в себя комплексные диагностические исследования методом полимеразной цепной реакции (ПЦР), согласно Инструкции по применению набора реагентов «ПЦР-МИКОПЛАЗМОЗ-ГАЛ/СИН-ФАКТОР», для выявления ДНК Mycoplasma gallisepticum и Mycoplasma synoviae в биологическом материале методом полимеразной цепной реакции (ПЦР) с флуоресцентной детекцией в режиме реального времени (ООО «ВЕТ ФАКТОР», г. Москва).
Результаты и обсуждение
На птицефабрике по производству мяса цыплят-бройлеров в Центральном регионе (Россия) при клиническом наблюдении за птицей было выявлено, что цыплята-бройлеры развиваются в соответствии с нормативными показателями кросса Cobb-500. Однако был отмечен повышенный падеж после 20-го дня выращивания птицы, а также выбраковка цыплят-бройлеров с патологией суставов. Предрасполагающие факторы к такой ситуации, по-видимому, были связаны с плотностью посадки птицы на 1 м2 и ростом общего удельного веса патогенных бактерий в птичнике.
При клиническом обследовании нами, совместно со специалистами птицефабрики было замечено, что примерно у 4% цыплят-бройлеров наблюдается патология суставов, а при патологоанатомическом вскрытии у цыплят-бройлеров обнаруживали артриты и некроз головки бедренной кости (начиная с 12-го дня жизни и до конца откорма) (фото 1–9).
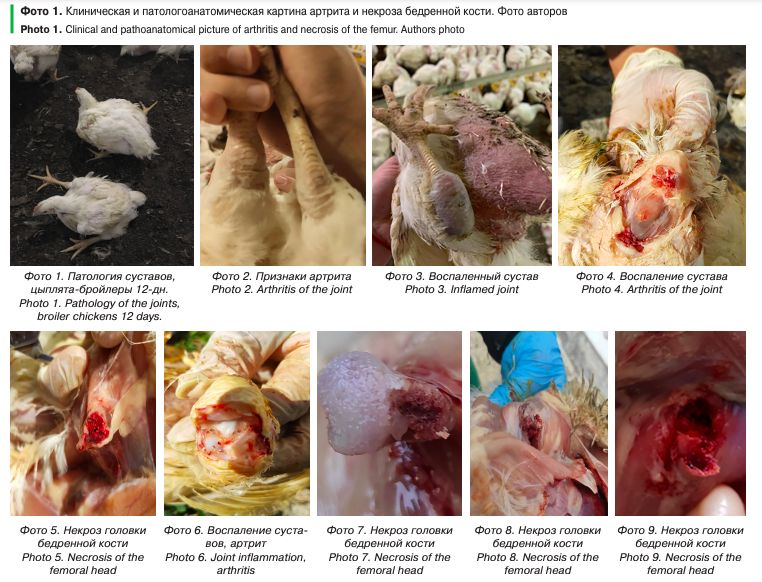
Во время вскрытия был отобран патологический материал для лабораторного исследования 25 проб от цыплят-бройлеров для выделения, идентификации и определения чувствительности к антибактериальным препаратам микробных культур.
Также пробы были направлены на выполнение гистологического исследования тканей суставов и молекулярно-генетического исследования (ПЦР).
При анализе предоставленного протокола лабораторных исследований микробного спектра, выделенных бактерий от цыплят-бройлеров наибольший удельный вес занимали патологии, связанные с E. coli, Staphylococcus spp., Streptococcus spp. Необходимо отметить, что в основном из паренхиматозных органов (печень, сердце, легкие, селезенка) были обнаружены E. Coli; а из содержимого головного мозга, носовых пазух и трахеи — E. Coli, Staphylococcus aureus, Staphylococcus pluranimalium.
В исследовании наиболее потенциальными возбудителями артрита и некроза головки бедренной кости были Staphylococcus aureus иE.Coli, выделенные из суставов и трубчатых костей цыплят-бройлеров.
Было установлено, что все включенные в исследование на чувствительность к антибактериальным препаратам выделенные изоляты бактерий, особенно Staphylococcus spp. (в основном выделенная из суставов, трубчатых костей), обладали наибольшей чувствительностью к препаратам «Коликвинол®», «Клавуксицин®», «Спелинк®-44», «Спелинк®-660», «Клиндаспектин®», «Квинолайн®», «Флокс-О-Квин®», «Квиноциклин®» (табл. 1).
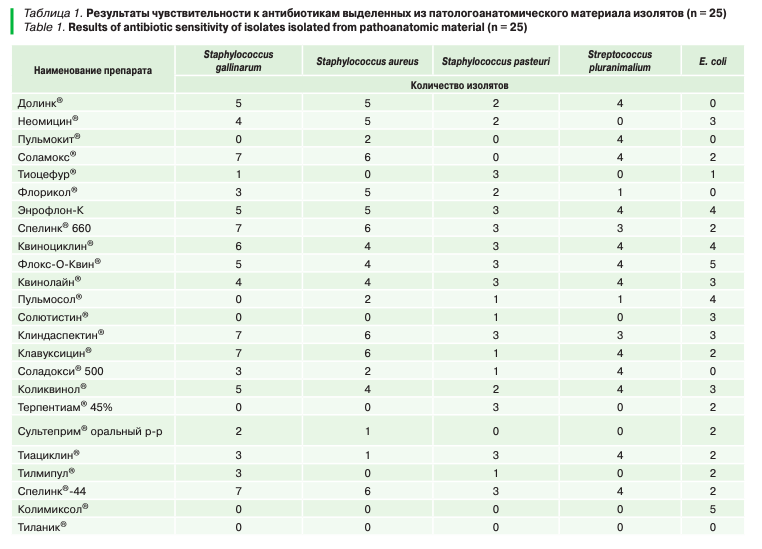
Следует отметить, что при определении чувствительности к антибактериальным препаратам в большинстве случаев штаммы Staphylococcus spp. и E.coli не проявили чувствительность к некоторым препаратам, что свидетельствует о циркуляции устойчивых патогенов к действующим веществам антибиотиков. Из протестированных препаратов наибольшей активностью против Staphylococcus spp. и E.coli обладал «Спелинк® 660» (табл. 1).
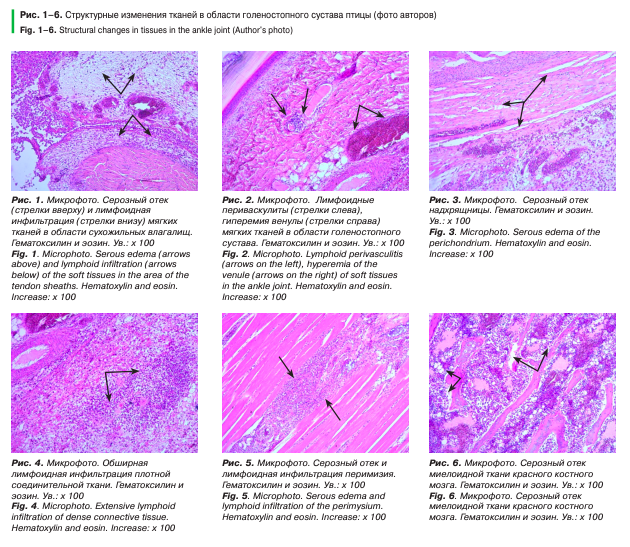
Для подтверждения клинических и лабораторных исследований о развитии воспалительного процесса в суставах было проведено гистологическое исследование четырех образцов тканей области голеностопного сустава цыплят-бройлеров 27-дневного возраста с макроскопическими признаками воспаления. Подготовка материала для гистологического исследования включала: декальцинацию образцов электролитным раствором; парафиновую заливку; изготовление гистологических срезов толщиной 6 мкм с последующей их окраской гематоксилином и эозином.
При исследовании образцов тканей (рис. 1–6) были выявлены обширные лимфоцитарные периваскулиты в подкожной клетчатке, межмышечной соединительной ткани, воспалительная гиперемия, серозный отек рыхлой соединительной ткани, а на некоторых участках — миелоидной ткани красного костного мозга.
Гистоархитектоника сухожильных влагалищ была нарушена в результате отека и скопления лимфоидноклеточного пролиферата, кровеносные сосуды гиперемированы, стенка артерий утолщена. Между волокнами плотной соединительной ткани также выявлены обширные участки скопления лимфоцитов и макрофагов. Надхрящница плотная, гипохромная.
Синовиоциты в состоянии деструкции местами отсутствуют в своем ложементе, местами увеличены в размере в результате вакуолизации цитоплазмы. В синовиальном пространстве присутствуют плохо дифференцируемые клеточные элементы. Нервные стволы с значительно утолщенным эпиневрием. В результате разрастания соединительной ткани структура миелиновых волокон неоднородная, границы полиморфные, пикнотичные, эндоневрий перфорирован, периневральное пространство значительно расширено (рис. 7–12).
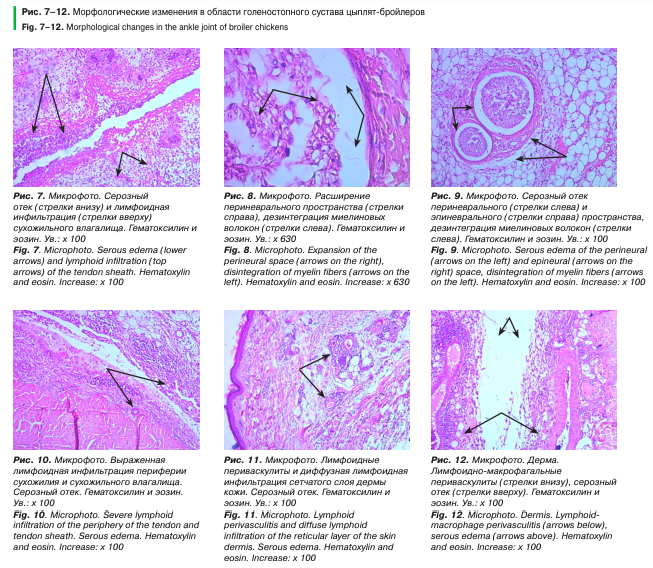
Структура гиалинового хряща и тканей эпифизов костей также сохранена, но стоит отметить усиленную лимфоидную инфильтрацию.
Таким образом, ведущие структурные нарушения в области голеностопного сустава характеризовались серозным воспалительным отеком подкожной клетчатки, васкулитом, теносиновитом и невритом. Подобная патология чаще встречается при болезнях бактериальной этиологии и реовирусной инфекции, как и микоплазмоз. Микоплазмоз был исключен на основании исследований проб суставов методом ПЦР.
Для решения проблем с патологией, связанной с так называемой трудной локализацией очага воспаления, в частности инфекции суставов, и на основании гистокартины воспаления суставов, выделения и идентификации бактерий, определения чувствительности патогенов к антибактериальным препаратам на предприятии по решению главного ветеринарного врача была оставлена утвержденная схема лечения, где в схеме терапии в критические периоды выращивания цыплят-бройлеров присутствовал препарат с действующими веществами энрофлоксацин и колистина сульфат, а для снятия проблемы патологии суставов у цыплят-бройлеров новой партии выращивания ввели в схему лечения препарат «Спелинк® 660».
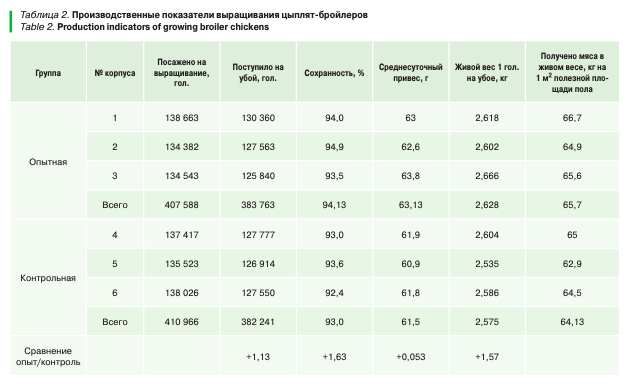
На птицефабрике, где ранее проводили клинические наблюдения, лабораторные и гистологические исследования, продолжен производственный опыт на следующей партии цыплят-бройлеров 818 554 голов кросса Cobb-500: в опытную группу — 407 588 голов, в контрольную — 410 966. Группы были подобраны по принципу аналогов с одинаковым содержанием, кормлением и программой вакцинации против вирусных болезней. Длительность производственного опыта — 41 день.
Контрольная и опытная группы цыплят-бройлеров получали препарат на основе энрофлоксацина и колистина сульфат согласно ранее утвержденной схеме лечебно-профилактических мероприятий на птицефабрике в критические периоды жизни птицы. Дополнительно опытной группе цыплят-бройлеров на основании лабораторных исследований была предложена схема лечения с акцентом на артрит и некроз головки бедренной кости. К утвержденной ранее схеме лечения был введен с первых дней жизни птицы препарат «Спелинк® 660»: 500 г/т питьевой воды в течение пяти дней.
В результате проведенного производственного опыта на птицефабрике в опытной группе визуально клинические признаки патологии суставов составили 1% (по сравнению с предыдущей партией выращивания цыплят-бройлеров ниже на 3%). В данной группе были получены положительные зоотехнические показатели: сохранность выше на 1,13 %, среднесуточный привес — 1,63 г, получено мяса в живом весе на 1 м2 полезной площади пола на 0,053 кг больше, чем в контрольной группе.
Выводы
Предрасполагающими факторами возникновения артрита и некроза головки бедренной кости при выращивании цыплят-бройлеров являются трансовариальное инфицирование, быстрый темп роста и высокий живой вес. Это приводит к аномалиям незрелых костей и суставов. При попадании бактерий в кровь, в частности Staphylococcus spp., они тянутся к богатым коллагеном поверхностям, таким как суставная поверхность и синовиальные оболочки, расположенным вокруг суставов, сухожилий, и локализуются в активно растущих костях, размножаются и образуют биопленку, тем самым препятствуют проникновению антибактериальных препаратов непосредственно в участок патологии.
Для цыплят-бройлеров на ранней стадии этого процесса применима рациональная антибиотикотерапия, основанная на выделении патогена и определении его чувствительности к антибиотикам предыдущих партий выращивания птицы эффективна.
Применение препарата «Спелинк® 660» цыплятам-бройлерам способствовало снижению выявления клинических случаев патологии суставов и получению более высоких зоотехнических показателей в конце откорма по сравнению с контролем.
Об авторах
Татьяна Владимировна Полуночкина, ведущий ветеринарный врач-консультант Департамента продвижения по птицеводству. Общество с ограниченной ответственностью Группа Компаний «ВИК», д. 681 с. Островцы, Раменский р-он, Московская обл.,140050, Российская Федерация
polunochkina@vicgroup.ru
Светлана Глебовна Дорофеева, кандидат ветеринарных наук, заместитель генерального директора по ветеринарии. Общество с ограниченной ответственностью Группа Компаний «ВИК», д. 681 с. Островцы, Раменский р-он, Московская обл.,140050, Российская Федерация
dorofeeva@vicgroup.ru
Виктория Васильевна Стаффорд, кандидат биологический наук, ведущий научный сотрудник, Всероссийский научно-исследовательский институт экспериментальной ветеринарии имени К.И. Скрябина и Я.Р. Коваленко Российской академии наук, Рязанский пр., д. 24, г. Москва, 109428, Российская Федерация
stafford.v.v@gmail.com
УДК 619:616-078:576.8 DOI: 10.32634/0869-8155-2023-367-2-39-46
Сельское хозяйство, ветеринария, зоотехния, агрономия, агроинженерия, пищевые технологии





















