Идентификация капсульной группы штаммов P. multocida фенотипическими методами в сравнении с методом мультиплексной ПЦР

Pasteurella multocida является возбудителем множества различных патологических форм пастереллезной инфекции, которые оказывают большое экономическое воздействие на животноводство во всем мире. Впервые P. multocida была показана как возбудитель птичьей холеры Л. Пастером в 1881 г., который получил микроорганизм в чистой культуре и разработал активную специфическую профилактику. Выделенный микроорганизм назван в честь Л. Пастера Pasteurella multocida, а вызываемое им заболевание — пастереллезом. К пастереллезу восприимчивы крупный рогатый скот, лошади, мелкий рогатый скот, буйволы, свиньи, грызуны, кошки, собаки, дикие животные, домашние и дикие птицы.
При благоприятных условиях пастереллез развивается и распространяется среди здоровых животных. В качестве патогена человека P. multocida приобретает все большее значение, вызывая раневые инфекции и даже септицемию, менингит и эндокардит.
В «Руководстве по диагностическим тестам и вакцинам для наземных животных (млекопитающих, птиц и пчел)» приводятся различные нозологии, вызываемые Pasteurella multocida, в частности геморрагическую септицемию крупного рогатого скота, атрофический ринит свиней, холеру птиц.
Болезнь характеризуется при остром течении признаками геморрагической септицемии, крупозным воспалением и отеком легких, плевритом, а при хроническом течении — гнойно-некротической пневмонией, артритом, маститом, кератоконъюнктивитом, атрофическим ринитом, тонзиллитом, менингитом, энцефалитом, эндометритом, иногда энтеритом и абортами у разнообразных домашних и диких животных.
Все нозологические формы заболеваний связаны с определенными капсульными и соматическими антигенами P. multocida. Капсула и липополисахарид (ЛПС) являются основными компонентами поверхности бактериальной клетки P. multocida и играют ключевую роль в ряде взаимодействий между бактериями и хозяевами, которых они колонизируют или заражают.
Еще в 1933 г. Y. Ochi исследовал штаммы P. multocida, выделенные от различных видов животных с признаками геморрагической септицемии. На основе серологических, иммунологических и патогенных свойств он смог разделить эти пастереллы на четыре группы, которые были обозначены буквами латинского алфавита в порядке возрастания: A, B, C и D.
Изоляты пастерелл, выделенные от птиц, были в группе A, изоляты крупного рогатого скота, буйволов и свиней — в группе B, изоляты овец, мышей и свиней — в группе C, некоторые изоляты овец — в группе D. Эти исследования заложили основу для дальнейшей типизации пастерелл по капсульным группам в реакциях агглютинации с типовыми сыворотками.
В дальнейшем на основе серологического типирования в реакции агглютинации с типовыми сыворотками были идентифицированы пять различных капсульных групп пастерелл, которые обозначили как А, В, D, E, F.
G. Carter типировал P. multocida различными методами, включая осаждение, набухание капсул и непрямую гемагглютинацию, и предположил, что несерологические методы могут заменить серологические процедуры типирования пастерелл по капсульным группам. G. Carter и E.Annau были первыми, кто продемонстрировал, что основным компонентом капсулы P. multocida типа A является гиалуроновая кислота. Затем было обнаружено, что штаммы пастерелл серологической группы А содержат гиалуроновую кислоту, а также типоспецифичный капсульный антиген. Капсулярная гиалуроновая кислота этих штаммов может быть деполимеризована нативной или стафилококковой гиалуронидазой.
Позднее K. Pandit и J. Smith посредством очистки, химических и иммунологических анализов подтвердили наличие гиалуроновой кислоты в капсуле P. multocida типа А.
G. Carter. и P. Subronto также сообщили, что биологические особенности штаммов P. multocida типа D позволяют им вызывать характерную крупную флокуляцию при суспендировании в растворе акрифлавина. Вещество, окрашивающееся генциановым синим, устойчивое к гиалуронидазе, с близкими хроматографическими свойствами, обнаруженное в экстрактах капсул штаммов типа D, считается кислым полисахаридом, отличным от гиалуроновой кислоты типа А. Ни гиалуроновая кислота, ни вещество, устойчивое к гиалуронидазе типа D, не были обнаружены в штаммах типа В или Е.
P. DeAngelis и др. определили, что основными компонентами капсульных полисахаридов P. multocida типа D и F являются немодифицированный гепарин (гепаросан) и хондроитин соответственно.
Широко задокументирована взаимосвязь между типом капсул, патогенезом и восприимчивостью хозяина к инфицированию возбудителем определенной капсульной группы.
Как геморрагическая септицемия, так и респираторные заболевания, включая пневмонию, являются распространенными инфекциями, связанными с P. multocida у крупного рогатого скота. Было отмечено, что штаммы P. multocida серотипа B обычно ответственны за геморрагическую септицемию, в то время как штаммы капсульной группы А чаще связаны с респираторными заболеваниями крупного рогатого скота.
A. Kumar и др. исследовали распространенность серотипов P. multocida в образцах биоматериала от различных видов животных в Индии. Изоляты P. multocida, обнаруженные в патматериале от крупного рогатого скота, относились преимущественно к типу A3, что находится в соответствии с результатами, описанными выше.
Исследования, выполненные S. Dabo и др., показали, что 80% изолятов P. multocida от КРС с пневмонией относились к серотипу A. В более позднем исследовании до 92% P. multocida, выделенные от крупного рогатого скота, также оказались серогруппой А.
Изучение случаев пастереллеза крупного рогатого скота в Белоруссии показало, что у 16,56% телят, больных септической формой, выделяли P. multocida типа В, у 4,46% больных животных — тип D. От животных с признаками пневмонии выделяли в основном серотипы D (26,11%) и A (19,74%), реже тип B (2,23%).
Примерно такие же результаты получены в исследовании F. Blanco-Viera и др., в котором 61% и 25% P. multocida, выделенных при легочных поражениях телят, относились к капсульным группам A и D соответственно.
P. multocida капсульной группы A (и в меньшей степени группы D) вызывают холеру у птиц. Для получения информации о распределении капсульных серогрупп в стадах птицы K. Rhoades и R. Rimler исследовали птичьи штаммы P. multocida, выделенные от различных видов птицы и различного географического местоположения. Из 246 исследованных штаммов P. multocida 166 штаммов были капсульной группы А, 4 штамма — группы В, 4 — группы D, 14 штаммов — группы F. 58 штаммов были некапсулированными, следовательно, не поддавались серогруппировке.
Атрофический ринит и пневмония, в первую очередь свиней, связаны с токсигенными штаммами серогруппы D и серогруппы A соответственно. Мониторинговые исследования, выполненные в Японии, Дании, Англии, Германии, Австралии, Корее, Венгрии, Китае и России, показали, что в большинстве случаев вспышки пневмонии были связаны с нетоксигенными штаммами P. multocida капсульного типа А и капсульного типа D, тогда как вспышки атрофического ринита у свиней были связаны с токсигенными toxA-вариантами P. multocida капсульного типа D.
Капсульное и соматическое серотипирование 79 культур P. multocida от кроликов показало, что 74 были капсульного типа A, как определено с помощью теста на деполимеризацию капсулы гиалуронидазой стафилококка, а 5 — типа D (определено с помощью теста на флокуляцию акрифлавина).
По данным Y. Lu и др., основными серотипами изолятов P. multocida, полученных от кроликов с ринитом, пневмонией, конъюнктивитом или кожными абсцессами, были серотипы A.
Штаммы P. multocida капсульной группы F преимущественно изолировали от больных домашних птиц, однако известны случаи выделения штаммов группы F от кроликов и телят, павших с картиной фибринозного перитонита.
Связь между определенными заболеваниями или хозяевами и капсульной серогруппой, как описано выше, указывает на важность точной идентификации капсульных групп изолятов P. multocida для изучения патогенеза и эпизоотологии пастереллеза, а также для изучения разнообразия изолятов P. multocida, выделенных от разных видов животных.
К сожалению, непрямой тест на гемагглютинацию с гомологичными сыворотками для идентификации капсульной группы пастерелл по G. Carter технически сложен, требует много времени для выполнения и может завершиться неудачей вследствие неспецифических перекрестных реакций, в связи с чем не нашел широкого применения в лабораторной практике.
G. Carter (23, 25) разработал и предложил метод несерологического типирования пастерелл, основанный на выявлении гиалуроновой кислоты в капсуле пастерелл капсульной группы А с последующей дифференциацией капсульных типов В и D по типу реакции в трипафлавиновой пробе. Эти два теста рекомендованы МЭБ и используются в нашей стране для типирования пастереллпо капсульным группам (Методические указания по лабораторной диагностике пастереллезов животных и птиц, утв. 20.08.1992 № 22-7/82 Главным управлением ветеринарии Министерства сельского хозяйства РФ).
К недостаткам способов несерологического типирования пастерелл относятся низкая специфичность, невозможность типирования пастерелл капсульных групп E и F, вероятность возникновения спонтанных мутаций, приводящих к появлению безкапсульных вариантов бактерии, что приводит к невозможности их типирования по данному способу.
В последние годы для выявления P. multocida и генотипирования ее капсульных групп разработано несколько тест-систем на основе ПЦР c электрофоретической детекцией результатов исследований.
Во Всероссийском государственном центре качества и стандартизации лекарственных средств для животных и кормов (ФГБУ «ВГНКИ») разработана мультиплексная система для типирования пяти капсульных групп P. multocida. В качестве генов-мишеней были выбраны гены капсульных полисахаридов hyaD, fcbD, dcbF, bcbD, ecbJ — уникальные для каждой капсульной группы гены, кодирующие белки, которые вовлечены в синтез группоспецифичных капсульных полисахаридов.
Цель данного исследования — сравнение результатов несерологического типирования штаммов P. multocida по капсульным группам фенотипическим методом и мультиплексной ПЦР для идентификации капсульных генов, специфичных для пяти капсульных групп P. multocida.
Материалы и методы исследования
В работе использовали штаммы P. multocida из коллекции ФГБУ «ВГНКИ», выделенные в разные годы от различных животных. Эталонные штаммы P. multocida ATCC 43137 (капсульный тип A), ATCC Kobe-6 (27883) (капсульный тип D), ATCC R-473 (капсульный тип B) были выбраны в качестве положительного контроля для фенотипических тестов и мультиплексной ПЦР, тест-культура Staphylococcus aureus 12600 ATCC — для теста на гиалуронидазу.
Все отобранные штаммы хранились в лиофилизированном состоянии при температуре 2–8 °C. Реактивация штаммов и предварительные испытания для подтверждения чистоты образцов P. multocida были выполнены в соответствии с МУК No22-7/82 от 20.08.1992. Штаммы реактивировали в бульоне Хоттингера (HiMedia), инкубировали при 37 ± 1 °C в течение 24 часов. По истечении этого периода выросшие культуры пересевали на основу кровяного агара (HiMedia) c 5% дефибринированной крови барана и на агар Макконки (HiMedia) для контроля отсутствия роста P. multocida и помещали в термостат при 37 ± 1 °C на 24–36 часов.
Чистоту роста оценивали визуально по морфологии колоний, выросших на кровяном агаре. Колонии, предположительно относящиеся к Pasteurella sp., окрашивали по Граму и исследовали под иммерсией на наличие биполярности и тестировали с использованием идентификационных тест-систем API-20NЕ и API-20Е (Биомерье, Франция) в соответствии с инструкцией изготовителя с подтверждением видовой идентификации ПЦР-методом (RotorGene 6000 и RotorGene Q (Corbett Research, Австралия; Qiagen, Германия).
Фенотипическое типирование штаммов пастерелл по капсульным группам в гиалуронидазной трипафлавиновой пробе (несерологическое типирование)
Типирование штаммов пастерелл по капсульным группам в гиалуронидазной трипафлавиновой пробепроводили в соответствии с МУК1 № 22-7/82 иРуководством МЭБ по диагностическим тестам и вакцинам. Изучаемую 18-часовую бульонную культуру Р. multocida высевали штрихами на чашку Петри с 1,5%-ным агаром Хоттингера, чтобы получить линии роста примерно 3–5 мм друг от друга. Одновременно вслед за этим посевом по диаметру чашки одной прямой линией высевали бактериологической петлей бульонную культуру Staphylococcus aureus (штамм 12600 АТСС), способную продуцировать фермент гиалуронидазу. Посевы инкубировали в течение 14–16 часов при температуре 37 ± 1 °C и просматривали в косо проходящем свете.
Штаммы P. multocida группы А из-за расщепления гиалуронидазой стафилококка гиалуроновой кислоты в капсуле пастерелл вблизи (до 5 мм) от линии роста S. aureus образуют более мелкие колонии, в отличие от колоний пастерелл групп B и D.
Далее все испытуемые культуры, независимо от типа реакции с гиалуронидазой, исследовали в трипафлавиновой (акрифлавиновой) пробе, для чего испытуемую культуру выращивали 24 часа при 37 ± 1 °C в 3–5 мл бульона Хоттингера, центрифугировали при 3000 об/мин, часть супернатанта (~4,5 см3) удаляли, осадок ресуспендировали в оставшейся жидкости и добавляли в пробирку 0,5 см3 свежеприготовленного раствора акрифлавина 1:1000. (Sigma). Компоненты перемешивали и выдерживали 10–20 мин.при комнатной температуре. Штаммы, относящиеся к группе D, в течение 10–15 мин. после добавления раствора акрифлавина образуют крупнохлопчатый неразбивающийся при встряхивании флоккулят. Штаммы P multocida, не обладающие указанными выше свойствами, относили к группе В.
Полученные результаты сравнивали с результатами идентификации капсульных групп P. multocida, установленных методом мультиплексной ПЦР.
Результаты и обсуждения
В таблице 1 представлены сравнительные результаты биохимического (несерологического) типирования штаммов пастерелл по капсульным группам в реакции с гиалуронидазной и в трипафлавиновой пробе и методом ПЦР, между которыми была установлена значительная разница.
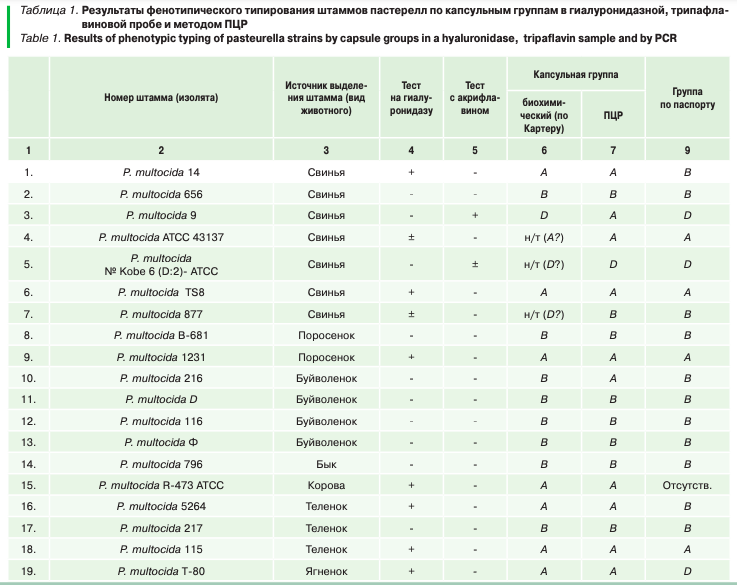
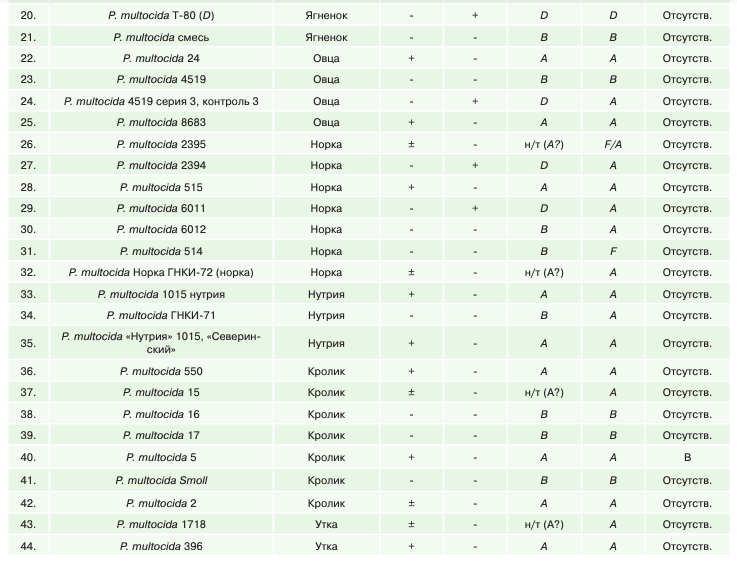
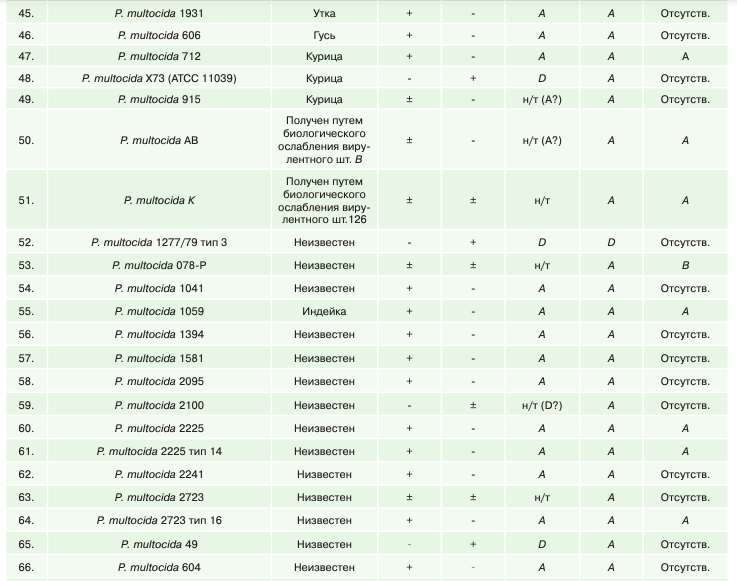
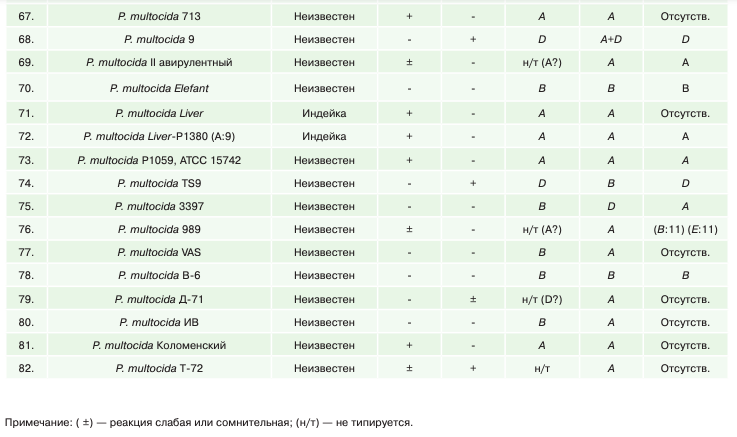
Анализ результатов типирования пастерелл по капсульной группе в тестах с акрифлавином и гиалуронидазой по Картеру показал, что к капсульной группе А было отнесено 34 штамма (41,46%), капсульной группе D — 9 штаммов (10,96%), к капсульной группе В — 16 штаммов (25,61%). Количество нетипируемых или сомнительных по биохимическим свойствам штаммов пастерелл — 17 штаммов (29,73%).
Результаты молекулярно-генетического типирования штаммов пастерел методом ПЦР показали, что к капсульной группе А было отнесено 59 штаммов (72,67%), капсульной группе D — 4 штамма (4,93%), к капсульной группе В – 16 штаммов (19,71%), к капсульной группе F — 1 штамм (1,23%). Количество нетипируемых методом ПЦР штаммов пастерелл — 2 штамма (2,46%).
Из 82 штаммов не совпали результаты типирования между ПЦР и типированием по Картеру по капсульной группе А в отношении 25 штаммов, по капсульной группе D в отношении 5 штаммов и по капсульной группе В — в отношении 5 штаммов.
Помимо этого, установлено расхождение результатов фенотипического и молекулярного типирования части музейных штаммов пастерелл с капсульной группой по Картеру, указанной в паспорте на штамм. Тест на гиалуронидазу и акрифлавин не подтвердил капсульную группу 5 из 33 музейных штаммов пастерелл, ПЦР-типирование не подтвердило капсульную группу 8 из 33 музейных штаммов пастерелл. Наибольшее количество несовпадений между результатами биохимического (несерологического) типирования и типирования методом ПЦР установлено в отношении капсульной группы А.
Это исследование показало, что оба несерологических метода (тест на гиалуронидазу и акрифлавин) для дифференциации пастерелл группы А и D имеют определенные ограничения. Основной проблемой, с которой сталкиваются при анализе итогов типизации, является интерпретация результатов. Общепринятое мнение состоит в том, что пастереллы капсульной группы А чувствительны к гиалуронидазе и не образуют крупные хлопья в среде с акрифлавином. На этом принципе основано чтение реакции — колонии пастерелл вблизи штриха тест-культуры либо не растут, либо образуют прореженный рост.
Химическое сходство полисахаридов, из которых состоит капсула пастерелл, может влиять на специфичность фенотипических тестов. Например, некоторые штаммы пастерелл капсульного типа D могут демонстрировать небольшое уменьшение размера колонии при выращивании вблизи тест-культуры Staphylococcus aureus, вследствие того, что эти штаммы могут обладать небольшим количеством периферической гиалуроновой кислоты. Кроме штаммов P. multocida группы D, флоккулят могут образовывать диссоциированные культуры других групп, но в этом случае флоккулят мелкохлопчатый и легко разбивается при встряхивании. Различия в интерпретации для этих двух методов были отмечены в других исследованиях.
Прямых сравнений традиционных несерологических методов капсульного типирования штаммов P. multocida и методов, основанных на ПЦР, проведено недостаточно, однако близкие к полученным нами результатам капсульного типирования 114 штаммов P. multocida, выделенных от различных животных фенотипическими и генотипическими методами, приводят N. Arumugam и др. Так, тест на гиалуронидазу дал расхождение с результатами ПЦР в отношении 38 штаммов, тест на флокуляцию акрифлавина ошибочно отнес 15 штаммов к серогруппе D, тогда как методом ПЦР-анализа было показано, что они относятся к серогруппе А.
Фенотипические тесты не смогли окончательно идентифицировать четыре из протестированных изолятов, даже несмотря на то, что ПЦР идентифицировала их как тип D. Исследование показало, что 55 из 114 (48,24%) штаммов P. multocida, полученных от разных животных, были нетипированы с использованием только тестов на гиалуронидазу и акрифлавин. Однако в этом исследовании штаммы, классифицированные как нетипируемые, были отрицательными и по тесту на гиалуронидазу, и по тесту на акрифлавин, тогда как в нашем исследовании часть штаммов показали сомнительные или ложноположительные реакции на оба реагента.
Аналогичным образом было обнаружено, что 49 из 54 штаммов (90,74%), выделенных во время вспышки холеры у домашней птицы в Бразилии, при идентификации мультиплексной ПЦР были отнесены к группе А, и только два изолята (3,7%) не были идентифицированы. В отличие от этого, при использовании фенотипических тестов только 41 штамм (75,93%) был классифицирован как группа А и 11 образцов (20,37%) не поддавались идентификации. Из проанализированных штаммов 70,37% были отнесены к одной и той же серогруппе (А) фенотипическим и молекулярно-генетическими методами, однако коэффициент корреляции (k = 0,017) указывал на плохое соответствие между тестами.
K. Brogden и др. исследовали 32 типоспецифические культуры, используемые в четырех системах типирования P. multocida, включая тесты на агглютинацию, реакцию декапсуляции гиалуронидазой и реакцию на акрифлавин, гель-диффузионный преципитационный тест Хеддлстона и заключили: когда эталонные культуры исследовались с помощью метода типирования, исходя из которого они были описаны, результаты, как правило, коррелировали с полученными результатами. Однако капсульные типы, определенные одной системой типирования, обычно не коррелировали с таковыми, определенными другой системой, из-за чего невозможно установить надежную корреляцию между результатами капсульного типирования P. multocida, определенными с помощью различных систем типирования.
Использованные нами в работе гиалуронидазный и акрифлавиновые тесты, в отличие от метода ПЦР, не дают возможности для типирования пастерелл групп E и F, но и капсульная группа некоторых штаммов P. multocida методом ПЦР также не установлена.
Таким образом, мультиплексная ПЦР является более точным методом капсульного типирования P. multocida, поскольку позволяет провести одновременное и быстрое типированиие штаммов пастерелл по пяти капсульным группам, но в ряде случаев не дает однозначного ответа на принадлежность штамма к определенной капсульной группе.
Выводы
Проведено исследование 82 штаммов P. multocida коллекции ФГБУ «ВГНКИ» по капсульной группе биохимическими и молекулярно-генетическими методами. Выявлено несовпадение результатов типирования между ПЦР и типированием по Картеру: по капсульной группе А в отношении 25 штаммов, по капсульной группе D в отношении 6 штаммов и по капсульной группе В в отношении 5 штаммов.
Наибольшее количество несовпадений результатов типирования пастерелл по капсульным группам по Картеру и методом ПЦР установлено для капсульной группы А, что может быть связано, с одной стороны, низкой чувствительностью штаммов к гиалуронидазе и субъективной оценкой величины образующихся хлопьев в акрифлавиновой пробе, а с другой — вероятностью возникновения спонтанных мутаций, приводящих к появлению безкапсульных вариантов бактерии, и способствует невозможности типирования или получению ложноположительных результатов.
Фенотипический метод не дает возможности для типирования пастерелл групп E и F, тогда как метод ПЦР позволяет типировать все капсульные группы (А, В, D, E, F).
На основании полученных данных можно сделать вывод, что использование молекулярно-генетических методов капсульного типирования пастерелл повышает специфичность идентификации, но в ряде случаев не дает однозначного ответа на принадлежность штамма пастерелл к определенной капсульной группе.
Об авторах
Нина Ивановна Малик, доктор биологических наук, профессор; Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов, Звенигородское шоссе 5, Москва, 123022, Российская Федерация
E-mail: nimalik@vgnki.ru
Лия Андреевна Маленкова, научный сотрудник; Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов, Звенигородское шоссе 5, Москва, 123022, Российская Федерация
E-mail: malenkova@vgnki.ru
Евгений Васильевич Малик, кандидат ветеринарных наук; Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов, Звенигородское шоссе 5, Москва, 123022, Российская Федерация
E-mail: evmalik@vgnki.ru
Ирина Александровна Гулейчик, кандидат биологических наук; Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов, Звенигородское шоссе 5, Москва, 123022, Российская Федерация
E-mail: i.guleichyk@vgnki.ru
Наталия Александровна Чупахина, кандидат биологических наук; Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов, Звенигородское шоссе 5, Москва, 123022, Российская Федерация
E-mail: n.chupahina@vgnki.ru
Иван Анатольевич Русанов, кандидат ветеринарных наук; Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов, Звенигородское шоссе 5, Москва, 123022, Российская Федерация
E-mail: rusanov@vgnki.ru
Надежда Сергеевна Самохвалова, научный сотрудник; Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов, Звенигородское шоссе 5, Москва, 123022, Российская Федерация
E-mail: n.samokhvalova@vgnki.ru
УДК 579.841/.842:615 DOI: 10.32634/0869-8155-2023-367-2-54-63
Сельское хозяйство, ветеринария, зоотехния, агрономия, агроинженерия, пищевые технологии





















