Особенности состава пищеварительной микробиоты у сельскохозяйственной птицы при загрязнении кормов глифосатом

Пищеварительный тракт птицы в большей степени, чем другие органы и системы организма, подвержен воздействию различных раздражителей — начиная от принятой пищи и заканчивая лекарственными препаратами. Поэтому в структуре падежа птицы отход по причине заболеваний органов пищеварения достигает 30%. Лекарственные препараты, без которых не обойтись в условиях промышленного производства яиц и мяса птицы, влияют прежде всего на кишечную микрофлору, изменяя ее в количественном и качественном соотношении, и вызывают дисбактериоз и нарушение баланса некоторых витаминов. Эти изменения проявляются тем сильнее, чем больше дозы препаратов и длительнее их применение. Некоторые антимикробные препараты, например энрамицин или мадурамицин, оказывают негативное действие непосредственно на слизистую оболочку кишечника, печень, ткани сердца.
В пищеварительной системе птиц присутствуют около 600–900 видов бактерий.
Основной функцией нормофлоры является выработка ферментов (целлюлаз, протеаз и др.), необходимых для пищеварения, участия в обмене веществ, защиты организма от патогенов и токсинов, синтеза летучих жирных кислот и витаминов, формирования иммунитета и др. Всё это имеет прямую связь с состоянием здоровья, продуктивностью, сохранностью, сроком хозяйственного использования птицы.
Помимо нормофлоры, в кишечнике птиц присутствуют микроорганизмы, представляющие угрозу здоровью, их называют условно-патогенными (энтеробактерии, кориобактерии и др.) и патогенными (сальмонеллы, пастереллы и др.). Пока микрофлора кишечника и иммунитет в норме, их содержание находится на низком уровне, однако в случае снижения резистентности происходят нарушения микроэкологии кишечника — дисбиозы. Увеличение количества условно-патогенных форм вызывает метаболические и иммунные расстройства организма, что отражается на продуктивности, сохранности поголовья и качестве продукции.
Широкое применение в мире популярного гербицида глифосат, а также ввоз кормового сырья из генетически модифицированной сои, устойчивой к глифосату, приводят к повышенному содержанию пестицида в комбикормах.
Проведен мониторинг присутствия глифосата в комбикормах для разных возрастных групп птиц из различных регионов европейской части России. В 96% исследованных образцов комбикормов для птицы зафиксировано присутствие глифосата, в 25% образцов обнаружено превышение нормы по данному токсиканту.
Механизм действия глифосата основан на ингибировании фермента 5-енолпирувил шикиматфосфатсинтазы — ключевого участка шикиматного пути синтеза трех важнейших аминокислот. У большинства микроорганизмов шикиматный путь является единственным способом синтеза незаменимых аминокислот, поэтому глифосат негативно воздействует на микроорганизмы. В исследовании влияния глифосата на микрофлору птицы показано, что представители нормофлоры не выживают даже при относительно низких концентрациях пестицида, в то время как многие патогены, такие как Clostridium perfringens, Salmonella enteriditis, Salmonella gallinarum, способны расти и размножаться в концентрациях глифосата до 5 мг/мл. Установлено, что глифосат стимулирует гиперпродукцию провоспалительных генов в кишечнике, что у птицы вызывает пирексию, анорексию, потерю живой массы и апатию. В связи с этим целью исследования было изучение состава микробиома слепых отростков цыплят-бройлеров при хроническом воздействии глифосата и введении в рацион пробиотического штамма микроорганизма.
Материал и методы исследований
Для современной диагностики и точного определения причин нарушений используются методы метагеномики (прежде всего NGS-секвенирование: next generation sequencing), позволяющие описать все 100% бактерий микробной экосистемы. В результате такого анализа все присутствующие микроорганизмы разбиваются по родам и видам и устанавливаются их функции.
Метод NGS-секвенирования позволяет охарактеризовать состав и баланс микрофлоры кишечника, определить «микробный статус» птиц, сделать выводы о вкладе микробиома в общее состояние здоровья, уровень продуктивности, а также об эффекте, который на него оказывают тот или иной компонент рациона, кормовая добавка или лекарственное вещество, как в краткосрочной, так и долгосрочной перспективе.
Эксперимент был проведен в виварии ООО «БИОТРОФ+» в мае — июне 2022 года на цыплятах-бройлерах кросса «Росс 308» в соответствии с требованиями Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях.
Условия кормления и содержания соответствовали требованиям для кросса бройлеров. До 28-суточного возраста для кормления бройлеров использовали полнорационный комбикорм ПК5-1Г-1101 для бройлеров в возрасте от 1 до 4 недель (производства АО «Гатчинский комбикормовый завод», Россия). С 28-х по 35-е сутки выращивания цыплят кормили полнорационным комбикормом ПК-6-Г-1102 (производства АО «Гатчинский комбикормовый завод», Россия). Помимо этого, птица дополнительно получала витаминно-минеральную биологически активную добавку. Птицы были разделены на группы (по 65 голов в каждой группе): I — контрольная, получавшая рацион без введения глифосата, II — опытная, получавшая рацион с добавлением глифосата в дозе 10 мг/кг корма, что соответствовало 0,5 ПДК для продуктов питания СанПиН 1.2.3685-21 [18], III — опытная, получавшая рацион с добавлением глифосата в дозе 20 мг/кг корма, что соответствовало 1 ПДК для продуктов питания, а также пробиотик «Пробиоцид-Ультра» с первого дня жизни на основе спорообразующих микроорганизмов и органических кислот (производства ООО «БИОТРОФ», Россия) в дозировке 1 кг на 1 т готового корма. Продолжительность выращивания птиц — 35 суток. Режим поения, освещения и влажности соответствовал руководству по содержанию бройлерного поголовья кросса Росс 308. Подопытный и контрольный молодняк содержали в трехъярусных клетках, состоящих из блоков (ББ-1 производства НПО «Стимул-ИНК», Россия).
В конце эксперимента проводили отбор проб химуса слепых отростков кишечника от трех птиц из каждой группы (30–50 г) с максимально возможным соблюдением условий асептики вручную. Предварительно птиц убивали методом декапитации и проводили вскрытие. Отобранные образцы немедленно помещали в центрифужные стерильные пластиковые пробирки. Все образцы были заморожены при температуре 20 °C и транспортированы в сухом льду в молекулярно-генетическую лабораторию ООО «БИОТРОФ+» для последующего выделения ДНК. Тотальную ДНК выделяли с использованием набора Genomic DNA Purification Kit (Thermo Fisher Scientific, Inc., США) согласно прилагаемой инструкции. Метод основан на селективном детергентно-опосредованном осаждении ДНК из субстрата с применением растворов 1,2 М хлорида натрия и хлороформа для лизиса клеточных стенок и осаждения ДНК. Бактериальное сообщество слепой кишки оценивали методом NGS-секвенирования на платформе MiSeq (Illumina, Inc., США) с праймерами для v3-v4 региона 16S рРНК. Прямой праймер: 5´-TCGTCGGCAGCGTCAGATGTGTATAAGAGACAGCCTACGGGNGGCWGCAG-3´, обратный праймер: 5´-GTCTCGTGGGCTCGGAGATGTGTATAAGAGACAGGACTACHVGGGTATCTAATCC-3´. ПЦР проводили при следующих условиях: 3 мин. —при 95 °С, 30 сек. — при 95 °С, 30 сек. — при 55 °С, 30 сек. — при 72 °С (необходимо для удлинения последовательности) (25 циклов); 5 мин. — при 72 °С (окончательное удлинение). Секвенирование осуществляли при помощи реагентов для подготовки библиотек Nextera® XT IndexKit (Illumina, Inc., США), для очистки ПЦР-продуктов — Agencourt AMPure XP (Beckman Coulter Inc., США), для проведения секвенирования — MiSeq® ReagentKit v2 (500 cycle) (Illumina, Inc., США). Максимальная длина полученных последовательностей составила 2 × 250 п. н.
Биоинформатический анализ данных выполняли с помощью программного обеспечения QIIME2 ver. 2020.8 (https://docs.qiime2.org/2020.8/). После импорта последовательностей в формате .fastq из секвенирующего прибора и создания необходимых для работы файлов сопоставления (содержащих метаданные изучаемых файлов) парные строки прочтений были выровнены. Далее последовательности фильтровали по качеству с использованием параметров настроек по умолчанию. Фильтрацию шумовых последовательностей проводили с помощью встроенного в пакет QIIME2 метода DADA2, включающего информацию о качестве в свою модель ошибок, что делает алгоритм устойчивым к последовательности более низкого качества, при этом использовали максимальную длину последовательности обрезки, равную 250 п. н. (https://benjjneb.github.io/dada2/tutorial.html). Для построения филогении de novo выполнили множественное выравнивание последовательностей, применяя программный пакет MAFFT, далее проводили маскированное выравнивание последовательностей, чтобы удалить позиции, которые значительно различались. Для анализа таксономии использовали справочную базу данных Silva 138.1 (https://www.arb-silva.de/documentation/release-138.1/).
Математическую и статистическую обработку результатов осуществляли методом многофакторного дисперсионного анализа (Multifactor Analysis of Vаriance, ANOVA) в программах Microsoft Excel XP/2003, R-Studio (Version 1.1.453) (https://rstudio.com). Различия считали значимыми при р ≤ 0,05. Результаты представлены как средние значения (M) и стандартные ошибки средних (±SEM). Достоверность различий устанавливали по t-критерию Стьюдента, различия считали статистически значимыми при р ≤ 0,05. Средние значения сравнивали с использованием теста достоверно значимой разницы Тьюки (HSD) и функции TukeyHSD в пакете R Stats Package.
Результаты и обсуждение
Как оказалось, для каждого из патологических состояний организма (будь то заболевания или падение продуктивности) свойственно особенное количественное и качественное содержание микроорганизмов в кишечнике. Однако до последнего времени вопрос норм содержания бактерий в ЖКТ сельскохозяйственных животных и птиц оставался в тени.
В НПК «БИОТРОФ» на основании анализа нескольких тысяч образцов химуса из слепых отростков кишечника сельскохозяйственной птицы в 2013 г. были сформированы базы данных, в которых содержится информация о предельных долях основных групп микроорганизмов. Данные представлены в относительных величинах и являются ориентировочными, однако позволяют получить представление о качественном и количественном разнообразии микробиома сельскохозяйственной птицы.
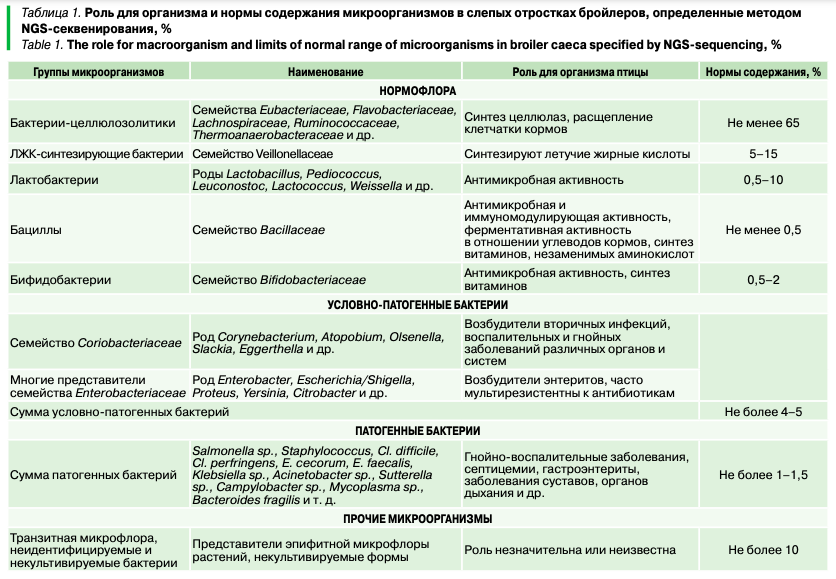
Таким образом, по значению доли представителей нормофлоры целлюлозолитиков можно оценить способность микробиоты расщеплять некрахмалистые полисахариды кормов, а значит, понять эффективность работы пищеварительной системы. В здоровом кишечнике суммарно эти бактерии должны доминировать (не менее 65%), падение их содержания говорит о нарушении процессов переваривания кормов. Доля бацилл (бактерий рода Bacillus) указывает на уровень способности синтезировать антимикробные вещества, а следовательно, уровень защищенности организма от заболеваний. В то же время для кишечного микробиома характерна выраженная гетерогенность свойств внутри рода в связи с высокой изменчивостью геномов бактерий. Разные виды бактерий внутри общей таксономической группы обладают совершенно разными свойствами. Поэтому, описывая состав микробиома пищеварительной системы, бактерии необходимо разделять не только по физиологическим группам, семействам, родам, но и по видам. Например, внутри рода Clostridium встречаются как патогенные формы, так и виды, связанные со здоровьем кишечника и, как следствие, с высокой продуктивностью и жизнеспособностью птицы. В частности, это C. butyricum — известный продуцент масляной кислоты. Масляная кислота является основным энергетическим материалом для клеток слизистой оболочки кишечника, а также она проявляет противовоспалительные свойства. Тем не менее микробиом пищеварительной системы птиц, как и любая сложная система, подвержен влиянию множества факторов, как внешних, так и внутренних, включающих состав рациона, системы содержания птицы, схемы лечения и вакцинаций, различающихся в зависимости от птицеводческих хозяйств. По этой причине содержание бактерий низких таксономических рангов (родов, видов) не может нормироваться строго. Интерпретация результатов количественных значений отдельных родов и видов бактерий у особей с заболеваниями или снижением продуктивности должна осуществляться с учетом особенностей организации процессов производства на каждой конкретной птицефабрике.
Важно, что на основании многолетних исследований микробиоты кишечника были выделены характерные для различных заболеваний профили видового состава патогенных бактерий (табл. 2).
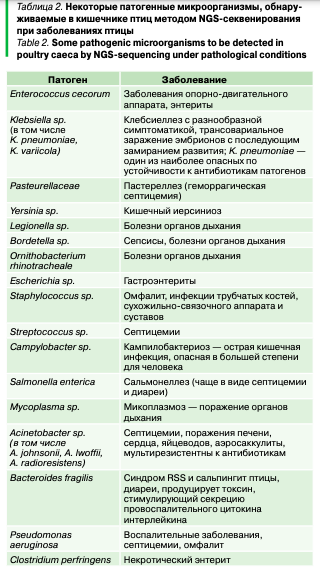
Получая профиль патогенных форм микроорганизмов, можно спрогнозировать риск развития заболеваний и проблем с продуктивностью, а также получить рекомендации по профилактике. При необходимости можно расширить программу исследований на птицефабрике и выявить наличие генетических маркеров факторов патогенности. Комплексное исследование проб воды, кормов, подстилки, смывов с поилок и кормушек может дать представление о циркуляции патогенов.
Известно, что основным резервуаром возбудителей инфекций являются корма, присутствие патогенов в которых — это одна из наиболее распространенных причин дисбаланса микрофлоры желудочно-кишечного тракта птиц.
Обобщая результаты анализов, проведенных на нескольких ведущих птицефабриках России, выяснилось, что среди патогенных и потенциально патогенных бактерий, взаимодействующих с кормами, встречались сальмонеллы (31% встречаемости в пробах), иерсинии (85%), Enterococcus cecorum (23%) и ряд других опасных возбудителей заболеваний. Большинство кормов было контаминировано одновременно несколькими патогенами. Например, Escherichia sp. и Staphylococcus sp. встречались во всех исследованных пробах.
Одной из проблем, влекущих нарушение микробиома птиц и возникновение других патологий, кроме патогенных микроорганизмов, является присутствие в кормах ксенобиотиков: микотоксинов и остаточных количеств пестицидов. Микотоксины, поступающие с кормами, подавляют полезных представителей кишечного биоценоза: целлюлозолитиков, расщепляющих клетчатку кормов и бактерий, синтезирующих летучие жирные кислоты. Это приводит к доминированию в кишечнике патогенных форм микроорганизмов.
Установлено, что микотоксины не редко превышают ПДК в большинстве кормовых ингредиентов для птиц. Чаще всего это Т-2 токсин, ДОН и др. Известно, что трихотеценовые микотоксины ингибируют синтез белка, РНК, ДНК, обладают дерматотоксическими свойствами, вызывая некрозы кожи, геморрагии в кишечнике и мышцах, дегенерацию печени и почек, индуцируют перекисное окисление липидов и разрушение клеток тимуса, селезенки, яичника, семенников. Ухудшается состояние оперения, возможны нервные расстройства. Прежде всего поражаются ротовая полость и зоб, птица теряет аппетит, снижаются темпы роста цыплят, продуктивность несушек и инкубационные качества яиц. При одновременном содержании этих микотоксинов в комбикормах синергический эффект негативного влияния на птицу усиливается. Дисбактериоз и диарея при остром токсикозе неизбежны.
Как правило, в комбикормах выявляются несколько микотоксинов, что также создает эффект синергизма и увеличивает риски негативного влияния их на птицу. Например, в наших исследованиях в комбикорме кукурузно-пшеничного типа для бройлеров слабой токсичности и пониженной на 10 ккал / 100 г калорийности за счет ферментного препарата было обнаружено четыре микотоксина в концентрациях ниже предельно допустимых норм (мг/кг ДОН — 0,3; фумонизин — 0,72; Т2 токсин — 0,061; охратоксин — 0,006), но за счет синергического эффекта они негативно влияли на результаты выращивания бройлеров. Добавка в такой комбикорм ферментного препарата в комплексе с пробиотиком способствовала повышению живой массы бройлеров на 3,6% при снижении затрат кормов на прирост на 2,4%. Кормовой антибиотик в сочетании с ферментным препаратом в таком комбикорме также обеспечил повышение живой массы бройлеров на 4,42% при снижении затрат кормов на прирост на 3,5%.
Методом NGS-секвенирования мы показали, что глифосат, содержащийся в загрязненных кормах для птиц, даже в минимальных концентрациях, которые в несколько раз ниже уровней ПДК для кормов, при хроническом воздействии может негативно влиять на микробные сообщества кишечника.
При проведении опыта на бройлерах кросса Росс 308 установлено, что в кишечнике птиц, получавших корма с введением глифосата, наблюдались дисбиотические нарушения в составе микроорганизмов, ферментирующих растительные полисахариды. Так, снижалось содержание бактерий семейства Lachnospiraceae. Это важные представители филума Firmicutes, которые ферментируют клетчатку до органических кислот, включая летучие жирные кислоты, что могло негативно сказаться на процессах переваривания и синтеза важных для птиц метаболитов, например бутирата. Кроме того, было показано, что глифосат подавляет экспрессию (работу) генов птицы, связанных с ростом и формированием мышечных волокон.
Помимо этого, в экспериментальной группе с загрязнением кормов данным токсикантом (по сравнению с контрольной группой без загрязнения) возрастало количество семейств микроорганизмов, среди которых представлено много патогенных и оппортунистических (условно-патогенных). Так, на фоне глифосата содержание стафилококков в кишечнике увеличивалось в 5,0 раз, энтеробактерий — в 1,5 раза. Дело в том, что кишечные бактерии значительно различаются по чувствительности к глифосату в зависимости от типа фермента EPSPS (ключевой фермент, который блокирует глифосат).
Ранее в исследованиях in vitro показано, что высокопатогенные бактерии птицы, такие как Salmonella entritidis, S. gallinarum, S. typhimurium, Clostridium perfringens и Cl. botulinum, обладают высокой устойчивостью к глифосату. Однако большинство полезных представителей нормофлоры, таких как Enterococcus faecium, Bacillus badius, Bifidobacterium adolescentis и Lactobacillus spp., оказались чувствительны к глифосату.
Избирательное действие глифосата связано с тем, что фермент EPSPS делится на четыре группы в зависимости от дифференциальной чувствительности к глифосату. Эта классификация основана на наличии и отсутствии аминокислотных маркеров в активном сайте (участке) белка. В целом виды, содержащие последовательности EPSPS класса I (α и β), чувствительны к глифосату, тогда как виды с последовательностями класса II, как правило, устойчивы. Белки EPSPS, принадлежащие к классам III и IV, предположительно приводят к устойчивости к глифосату и относительно редки в природе (< 5% последовательностей). У бактерий большинство видов имеют ферменты класса I и, таким образом, чувствительны к глифосату (82% у архей и 57% у бактерий), тогда как ферменты класса III (устойчивые к глифосату) составляют, соответственно, только 2% и 32% видов архей и бактерий.
Многочисленные исследования показали, что использование в комбикормах для птицы натуральных кормовых добавок производства НПК «БИОТРОФ» способствует снижению количества возбудителей гастроэнтеритов, заболеваний респираторной системы, опорно-двигательного аппарата, септицемий вплоть до полного исчезновения. Роль пробиотических добавок «Профорт», «Пробиоцид-Ультра», «Целлобактерин-Т», разработанных на основе методов полногеномного секвенирования, заключается в механизмах восстановления естественной резистентности нормобиоты.
На «первом рубеже» пробиотики конкурируют с патогенами за рецепторы слизистой оболочки кишечника, другим этапом их работы является синтез антимикробных веществ — карбоновых кислот и бактериоцинов. Применение указанных пробиотиков, обладающих ферментами биотрансформации токсинов, позволяет на 69% снизить отрицательное воздействие ксенобиотиков на организм. В частности, при использовании в комбикормах для бройлеров глифосата из расчета 20 мг/кг корма живая масса бройлеров к концу выращивания (35 дней) снижалась на 3,6% по сравнению с контролем. Наиболее существенной разница в живой массе была в 14-дневном возрасте бройлеров и составляла 4,7%, что согласуется с мнением о том, что наиболее чувствительны к «Десиканту» именно цыплята раннего возраста. Добавка к этому комбикорму цыплятам опытной группы пробиотика «Пробиоцид-Ультра» сокращала разницу в живой массе бройлеров по сравнению с контролем до 2,7%.
По сравнению с отрицательным контролем живая масса бройлеров при использовании пробиотика «Пробиоцид-Ультра» на фоне комбикормов, содержащих глифосат, повышалась на 1,0%. Это, в частности, было связано с тем, что под влиянием пробиотика «Пробиоцид-Ультра» в кишечнике птиц происходило снижение (по результатам NGS-секвенирования) численности таких клостридиальных кластеров (групп), как Clostridium_III, Clostridium_IV, Clostridium_sensu_stricto, Clostridium_XlVa, Clostridium_XlVb, Clostridium_XVIII (рис. 1). Суммарное снижение достигало 6,4%.
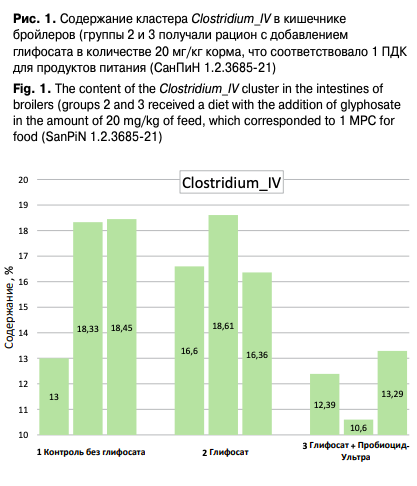
Известно, что виды Clostridium spp. имеют более высокую способность к образованию токсичных метаболитов среди кишечной микробиоты. Метаболиты Clostridium spp. могут приводить к избытку дофаминовых хинонов, образуя активные формы кислорода, что приводит к окислительному стрессу и митохондриальной дисфункции. Ранее показано, что воздействие глифосата приводило к выраженной бактериемии (проникновению в кровеносную систему) Clostridium. Кроме того, у цыплят, которые подвергались воздействию глифосата (370 ± 92 мкг/кг корма), наблюдали типичные симптомы клостридиоза, связанные с повышенным уровнем кишечных клостридий.
Выводы
Одна из причин, изменяющих состав микробиома птиц, — остаточные количества пестицидов (глифосат), которые нарушают баланс и снижают защитные функции микробного сообщества кишечника против патогенов.
Было показано, что контаминация кормов глифосатом негативно влияет на живую массу цыплят-бройлеров, а также приводит к изменениям в структурном составе миробиома цыплят-бройлеров. Под влиянием токсиканта происходит увеличение доли стафилококков в кишечнике в 5,0 раз, энтеробактерий — в 1,5 раза. Введение в рацион пробиотического штамма микроорганизмов на фоне загрязнения глифосатом позволяет сократить неблагоприятное воздействия гербицида на состав микробиома (в частности, в отношении представителей клостридиальных кластеров).
Об авторах
Тамара Михайловна Околелова, доктор биологических наук, профессор, Научно-внедренческий центр «Агроветзащита». Игарский проезд, д. 4, Москва, 129329, Российская Федерация
tokolelova@vetmag.ru; https://orcid.org/0000-0003-0271-2282
Георгий Юрьевич Лаптев, доктор биологических наук, профессор, генеральный директор, ООО «БИОТРОФ+», Загребский бульвар, д. 19, Санкт-Петербург, 192284, Российская Федерация
laptev@biotrof.ru; https://orcid.org/0000-0002-8795-6659
Дарья Георгиевна Тюрина, кандидат экономических наук, заместитель директора, ООО «БИОТРОФ+», ул. Малиновская, д. 8, г. Пушкин, Санкт-Петербург, 196602, Российская Федерация
tiurina@biotrof.ru; https://orcid.org/0000-0001-9001-2432
УДК 636.5.033/61.619 DOI: 10.32634/0869-8155-2023-368-3-32-39
Сельское хозяйство, ветеринария, зоотехния, агрономия, агроинженерия, пищевые технологии





















