Сравнение основных методов диагностики дерматофитозов

Часто практикующие ветеринарные врачи во время работы встречаются с животными, имеющими заболевания кожи. Для дифференциации кожных патологий существуют различные инструменты и методы. Дерматофитозы довольно редко имеют классическую клиническую картину – круглая алопеция, выпадение шерсти, шелушение кожи, иногда присутствует зуд и воспаление. Для подтверждения диагноза необходимо проведение дополнительных лабораторных исследований, независимо от опыта доктора. На практике чаще всего используется прямая микроскопия шерсти, при этом чувствительность метода будет зависеть от степени поражения – при ярко выраженных клинических признаках заболевания обнаружение возбудителя не вызывает затруднений. Однако при миконосительстве спор может быть небольшое количество, и их можно выявить не только на корне волоса.
Также существует модификация прямой микроскопии с использованием люминесцирующего агента калькофлюора белого. Грибы, при взаимодействии с красителем и раствором щелочи, поглощают калькофлюор, а при использовании люминесцентной микроскопии можно наблюдать голубое или зеленое свечение грибных элементов. Метод высокочувствительный, но для его использования необходимо иметь люминесцентный микроскоп и люминесцирующий агент.
Другой экспресс-метод, применяемый врачами-клиницистами непосредственно при оказании помощи – использование ультрафиолетовой лампы с фильтром Вуда. Результаты позволяют при первичном осмотре животного подтвердить диагноз по наличию флуоресценции участка волоса. Как и при микроскопии, отрицательный результат при использовании лампы Вуда не исключает наличие возбудителя.
Для подтверждения диагноза врачи могут передать шерсть в лабораторию, где с помощью ряда методов могут определить наличие дерматофитов. В современной диагностике возбудителей болезней, включая дерматофитозы, наиболее точными и эффективными являются молекулярно-генетические методы, прежде всего ПЦР-диагностика. Несмотря на явные преимущества в скорости и точности исследования, метод остается малодоступным, а высокая чувствительность может показывать ложноположительные результаты на наличие в материале нежизнеспособных дерматофитов. Кроме того, могут возникнуть затруднения при выделении ДНК грибов.
Наиболее распространенным лабораторным диагностическим методом для подтверждения дерматофитозов является микологический посев на питательные среды. Существует несколько вариантов сред для выделения возбудителя. Классическая среда Сабуро используется для культивирования практически всех грибов-микромицетов. Часто, при посеве клинического материала на среду Сабуро вырастают не только дерматофиты, но и грибы-контаминанты, которые растут быстрее, чем дерматофиты. Модификацией этой среды является добавление в ее состав циклогексимида, который частично или полностью ингибирует рост плесеней, не влияя на рост дерматофитов. Установить принадлежность выросших грибов к дерматофитам можно только по морфологии спороносящих органов, которые в среднем появляются к 10-14 дню. Это значительно замедляет время постановки диагноза и требует высокой квалификации лаборантов-исследователей.
Для ускоренной диагностики дерматофитозов была предложена среда ДТМ (DTM — Dermatophyte Test Medium), в состав которой входят среда Сабуро, циклогексимид и индикатор уровня pH. Особенность трофики дерматофитов – использование в качестве источника энергии в первую очередь пептонов, а у плесневых грибов – углеводов. После переваривания белков, в среду выделяются щелочные метаболиты, pH сдвигается в щелочную сторону и индикатор меняет цвет. Характерная колония белого цвета и изменение цвета среды дает основание подтвердить рост дерматофита. Как правило, изменение цвета происходит на 7-10 сутки. Кроме основных преимуществ по сравнению с посевами на другие среды, среду можно использовать в клиниках, при отсутствии контакта врача с культурой гриба.
Цель исследования – сравнение различных методов диагностики дерматофитозов. В соответствии с целью были сформулированы следующие задачи. 1. Практическое применение различных методов для лабораторной диагностики дерматофитозов. 2. Сравнительный анализ данных методов с оценкой их эффективности.
Материалы и методы
Патологический материал собирали от мелких домашних животных (кошек и собак), имеющих симптомы дерматофитозов. Волосы с корнем выщипывали пинцетом по краям алопеций. Собрано 54 образца волос, которые были исследованы следующими методами.
Диагностика с помощью лампы Вуда. Использовали лампу с фильтром Вуда в диапазоне длины волны 368-371 нм. Исследование проводили в темном помещении, предварительно прогревая лампу не менее 5 минут. Положительным считался результат, если шерсть имела люминесцентное свечение.
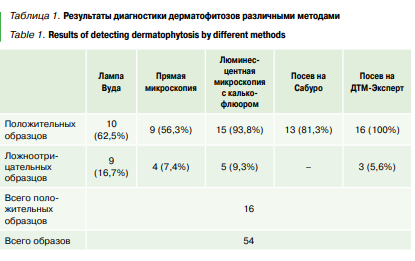
Прямая микроскопия. Для приготовления препарата с помощью скальпеля отделяли корень волоса, помещали его на предметное стекло, добавляли каплю щелочи (15% раствор NaOH). Далее накрывали покровным стеклом, короткое время прогревали над пламенем горелки, и, спустя 10 минут, проводили микроскопию при увеличении 200х. При необходимости детального рассмотрения препарата, использовали увеличение 400х. Результат считали положительным, если обнаруживали артроспоры и/или мицелий грибов.
Люминесцентная микроскопия с калькофлюором. Приготовление препарата из шерсти производили аналогично прямой микроскопии. По инструкции производителя красителя к одной капле 10% щелочи добавляли одну каплю BactiDrop Calcofluor White (Remel, USA). Накрывали покровным стеклом и проводили микроскопию на люминесцентном микроскопе с флюоресцирующим фильтром в диапазоне 400-500 нм. Результат считали положительным при обнаружении светящихся артроспор и/или мицелия грибов.
Посев на среды. Материал для посева измельчали с помощью скальпеля. В чашке/флаконе со средой размещали по 3-4 участка волоса в двух взаимно противоположных местах. Инкубировали при температуре 28 С ± 1 С в течение 21 суток. В исследовании использовали среду Сабуро производства HiMedia Laboratories Pvt. Limited (India), и «ДТМ-Эксперт» (ФГБНУ ФНЦ ВИЭВ РАН, Россия). Посев на среде Сабуро считали положительным, если вырастала типичная колония дерматофита, а при микроскопии культуры обнаруживали типичные макро- и микроконидии. Посев на среду «ДТМ-Эксперт» считался положительным, если на среде вырастала колония белого или кремового цвета, а цвет среды менялся с желтого на красный. Учет результатов на среде «ДТМ-Эксперт» проводили в соответствии с инструкцией изготовителя. Поскольку выделение чистой культуры дерматофита считается референсным методом подтверждения дерматофитозов, диагностическую эффективность всех методов оценивали относительно посевов на среду «ДТМ-Эксперт».
Результаты
При посеве 54 образцов шерсти удалось выделить 16 дерматофитов. Почти все выделенные дерматофиты принадлежали роду Microsporum. Большинство из них относились к виду M. canis. Результаты исследований представлены в таблице 1.
Эффективность среды «ДТМ-Эксперт» составила 100% (Рис. 1). В среднем, изменение цвета регистрировали на 8-10 сутки роста. В одном посеве наблюдали рост культуры, но изменение цвета не происходило даже спустя 21 суток. Культуру по результатам микроскопии идентифицировали как Nannizzia (Microsporum) persicolor. Количество ложноположительных изменений цвета среды составило 5,6% (3 из 54). Во всех случаях изменение вызывали плесени из рода Alternaria.

На среде Сабуро выросло 13 (81,3%) дерматофитов, из них 2 посева были сильно контаминированы плесневыми грибами. Отрицательными по дерматофитам были 13 посевов, к 7 дню они полностью зарастали плесенями. Чаще всего вырастали Alternaria sp. – в 8 случаях, реже Penicillium sp., Cladosporium sp. и Aspergillus sp., в одном посеве был обнаружен рост Trichothecium sp.
При исследовании шерсти с помощью лампы Вуда удалось выявить 62,5% (10 из 16) положительных образцов. Ложноположительных 16,7% (9 из 54).
С помощью прямой микроскопии дерматофитозы подтвердили только в 56,3 % (9 из 16) случаях. Ложноположительных результатов 7,4% (4 из 54) (Рис. 2).
Микроскопия с калькофлюором выявила возбудитель в 15 случаях, что составило 93,8%. При этом было 5 (9,3%) ложноположительных результатов (Рис. 3).
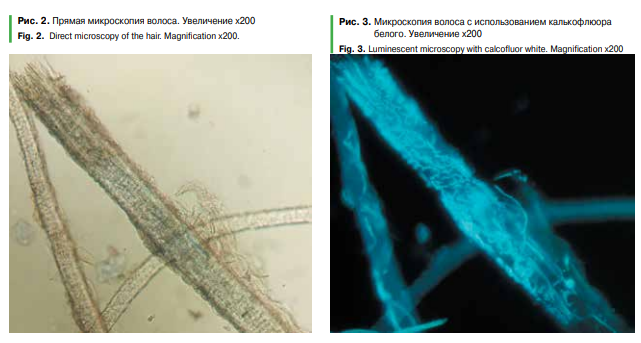
Рисунок 3. Микроскопия волоса с использованием калькофлюора белого Увеличение х200.
Наиболее высокую диагностическую эффективность в исследовании показали два метода: посев на «ДТМ-Эксперт» и люминесцентная микроскопия шерсти с использованием калькофлюора белого, эффективность этих методов составила 100% и 93,8%, соответственно, что согласуется с другими подобными исследованиями. Однако, несмотря на их высокую эффективность, они имеют и отрицательные стороны: на среде ДТМ иногда могут возникать ложноположительные изменения цвета. В данном случае следует иметь ввиду цвет колоний: дерматофиты имеют белый или кремовый цвет. В исследовании все три ложноположительные реакции возникали на рост плесеней из рода Alternaria, которые имели темно-зеленый или коричневый цвет колоний. Помимо этого, изменение цвета при росте дерматофитов возникает не раньше 5-6 суток после посева.
Заслуживает внимание выделение на среде ДТМ-Эксперт редкого вида дерматофита Nannizzia (Microsporum) persicolor. Возможно, данный случай является первым в ветеринарной практике на территории РФ.
Очевидно, что посев уступает по скорости диагностики другим экспресс-методам, прежде всего, методу прямой микроскопии с использованием калькофлюора. Для проведения диагностики требуется микроскоп с люминесцентным блоком, что редко встречается в лабораториях. В нашем исследовании метод показал высокую эффективность, а ложноположительные результаты, вероятно, возникали из-за высокой чувствительности – метод позволяет обнаруживать споры не только дерматофитов, но и других грибов. Чаще всего к ошибке приводят единичные споры, которые можно обнаружить на поверхности волоса. Большое скопление гиф и артроконидий практически всегда указывает на наличие возбудителя дерматофитозов.
Прямая микроскопия без красителя показала низкую эффективность, положительно подтвердив диагноз лишь в половине случаев. Метод также имеет низкую чувствительность, обнаружение единичных спор или гиф затруднено. Эффективность в большей мере зависит от опыта и навыков специалиста-исследователя.
Аналогичные результаты показал метод исследования шерсти с помощью лампы Вуда. Помимо низкой диагностической эффективности, в ходе исследования возникало много ложноположительных свечений шерсти, которые могли возникать по ряду причин.
Прямую микроскопию в КОН и тест с лампой Вуда следует использовать как вспомогательные методы при отборе наиболее подходящих образцов для посева.
Выводы
С учетом полученных результатов и сравнительной оценки эффективности методов диагностики дерматофитозов показано, что оптимальным вариантом представляется посев на среды ДТМ-типа, например, «ДТМ-Эксперт». Данный метод является наиболее эффективным и доступным, прост в применении и интерпретации результатов, не требует дорогостоящего оборудования и специальной подготовки персонала.
Финансирование. Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 19-316-90064.
Савинов В.А., Овчинников Р.С., Лаишевцев А.И., Гулюкин А.М., Капустин А.В.
Федеральное государственное бюджетное научное учреждение «Федеральный научный центр — Всероссийский научно-исследовательский институт экспериментальной ветеринарии имени К.И. Скрябина и Я.Р. Коваленко Российской академии наук» (ФГБНУ ФНЦ ВИЭВ РАН)
Сельское хозяйство, ветеринария, зоотехния, агрономия, агроинженерия, пищевые технологии





















